Digemid aún no emite permiso para que ingrese vacuna de Sinopharm al Perú
La Dirección General de Medicamentos, Insumos y Drogas enviará la información requerida por Cenares el próximo 27 de enero.
- Habilitan DNI electrónico sin costo para este grupo de peruanos: verifica si puedes acceder al beneficio
- Confirman bono de S/500 hasta por dos años para familias afectadas por lluvias en Arequipa
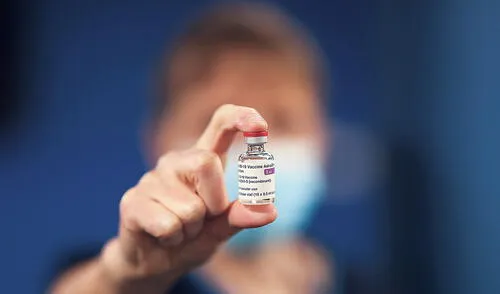
A través de información difundida por Cuarto Poder, se indicó que esta situación se da debido a que los funcionarios peruanos aún están a la espera de que la empresa china termine de entregarle los documentos claves sobre las certificaciones y funcionamiento de su laboratorio en Beijing.
TE RECOMENDAMOS
¿JAQUE MATE A JERÍ? EL CONGRESO LO CENSURA | ARDE TROYA CON JULIANA OXENFORD #FEEG2026
PUEDES VER: Revisa los candidatos y sus planes de gobierno

El medio de comunicación señaló que los papeles requeridos llegarán al Perú aproximadamente el miércoles 27 de enero.
El pasado 6 de enero, el presidente Francisco Sagasti anunció que la llegada del primer lote de vacunas contra el coronavirus del laboratorio chino sería este mes. Sin embargo, según la documentación, recién el 13 de enero el Centro Nacional de Abastecimiento de Recursos Estratégicos del Ministerio de Salud (Cenares) emitió el pedido de compra de las vacunas anunciadas, es decir, siete días después del anuncio presidencial. Al día siguiente, Cenares le pidió por primera vez a Digemid que evalúe la información presentada por Sinopharm.
El 20 de enero, la entidad le alcanzó al centro de abastecimiento observaciones y nuevas consultas sobre el laboratorio en Beijing y sobre sus prácticas de manufactura. Ante los nuevos requerimientos de la Dirección General de Medicamentos, la empresa china aseguró que entregaría información en un plazo mínimo de 7 días.
En tanto la institución reguladora no cuente con el registro y no la evalúe, no emitirá el permiso o registro sanitario condicional que necesita una vacuna de emergencia de este tipo.
Finalmente, si Digemid recibiera los datos el mismo 27 de enero, tiene 4 días, hasta el 31 de enero, para evaluarla y emitir la autorización condicional para que ingrese el producto.
Helicóptero de la FAP es hallado en Arequipa y confirman 4 tripulantes y 11 pasajeros muertos
ATU retira a perros de la estación Naranjal del Metropolitano en jaulas sin avisar a voluntarios: "No sabemos dónde están"
Lluvias en Perú hoy EN VIVO: nuevos desbordes y más de la emergencia por inundaciones en Arequipa, Ica, Tumbes y más regiones
Corte IDH condena al Perú por demorar más de 20 años en cumplir sentencia judicial a favor de jubilado
Recetas

Tallarines verdes peruanos: receta clásica deliciosa (VIDEO)

Cómo preparar un arroz con pollo tradicional riquísimo (VIDEO)

Sudado de pescado (VIDEO)

Escabeche de pollo receta: fácil y buenazo (VIDEO)
Ofertas

Cineplanet
CINEPLANET: 2 entradas 2D + 2 bebidas grandes + Pop corn gigante. Lunes a Domingo
PRECIO
S/ 47.90
Perulandia
PERULANDIA: FULL DAY + Piscinas + S/. 35 o S/.40 de VALE DE CONSUMO + Perusaurus y más. Según elijas
PRECIO
S/ 59.90
VACILANDIA PARK
VACILANDIA: Full Day + Vale de Consumo. Según elijas ¡DOMINGO 22 LA UNICA TROPICAL!
PRECIO
S/ 29.90
La Bistecca
ALMUERZO O CENA BUFFET + Postre + 1 Ice tea de Hierba luisa en sus 4 LOCALES
PRECIO
S/ 85.90


