COVID-19: Moderna inicia pruebas en adolescentes de su candidata a vacuna
La farmacéutica asegura que su objetivo es conseguir datos que respalden el uso de la vacuna experimental en adolescentes antes del año escolar 2021.
- El papa León XIV alerta avance de la extrema derecha en España: “Buscan ganar el voto católico”
- Trump dice que debe “participar” en la elección del próximo líder supremo de Irán, "como con Delcy Rodríguez" en Venezuela
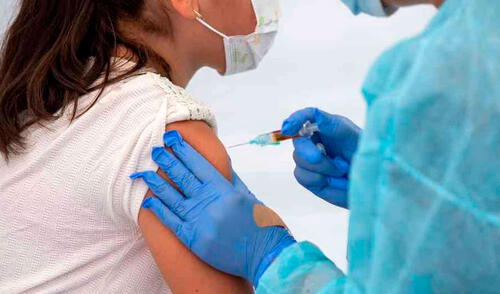
Tras confirmar que su potencial vacuna posee un 94% de eficacia contra la COVID-19 en la fase 3 de pruebas con adultos, la farmacéutica estadounidense Moderna anunció el comienzo de un estudio en adolescentes de entre 12 y 18 años.
A través de un comunicado difundido este jueves, Moderna asegura que el objetivo es recoger datos para la próxima temporada (marzo-junio) que respalden el uso de la candidata a vacuna en adolescentes antes que empiece el año escolar 2021.
TE RECOMENDAMOS
TIPOS DE MAGIA: BLANCA, NEGRA Y ROJA — MITOS, RIESGOS Y VERDADES | ASTROMOOD CON JHAN SANDOVAL
Según el jefe ejecutivo de Moderna, Stéphane Bancel, “este estudio en adolescentes nos ayudará a evaluar la seguridad potencial y la respuesta inmunitaria de nuestra candidata a vacuna para la COVID-19 en esta importante población de edad más joven”.
“Esperamos ser capaces de brindar una vacuna segura para ofrecer protección a los adolescentes y que puedan regresar a la escuela en un entorno normal”, agregó Bancel a EFE.
El laboratorio espera realizar el estudio en 3.000 adolescentes en Estados Unidos, a los que se les administrarán dos dosis con 28 días de diferencia (igual que en adultos) para analizar la seguridad, la reacción y la efectividad de la vacuna.
Después de la aplicación de vacuna experimental, Moderna resalta que se hará un seguimiento a los jóvenes durante los 12 meses posteriores a la segunda dosis.
El 17 de diciembre, el Comité Asesor de Productos Biológicos de la Agencia de Alimentos y Medicamentos (FDA) de Estados Unidos tendrá que determinar si la potencial vacuna de Moderna recibe la aprobación de emergencia para su distribución.
La farmacéutica asegura que su objetivo es conseguir datos que respalden el uso de la vacuna experimental en adolescentes antes del año escolar 2021. Foto: AFP
Este jueves, se espera que la FDA tome una decisión sobre la autorización de uso de emergencia de la vacuna contra la COVID-19 producida por Pfizer y BioNTech, que, de ser aprobado, comenzaría a ser distribuida en todo el país 48 horas después.
La eficacia general de Moderna es del 94%, con una eficacia del 87% en la prevención de la enfermedad moderada en adultos mayores, según Moncef Slaoui, asesor científico de Operación Warp Speed, el programa de Gobierno para el desarrollo de vacunas contra la COVID-19.
Tanto la vacuna de Pfizer como la candidata de Moderna requieren dos dosis, administradas con tres o cuatro semanas de diferencia. Las farmacéuticas han señalado que este 2020 deberían estar disponibles unas 40 millones de dosis, suficientes para vacunas a unas 20 millones de personas en Estados Unidos.
Cabe recordar que el pasado 2 de diciembre, el Reino Unido se convirtió en el primer país del mundo en aprobar la vacuna de Pfizer-BioNTech contra la COVID-19 para su uso de emergencia.
La campaña de vacunación empezó el martes 8 de diciembre en el país europeo con la inmunización de una mujer de 90 años. Las primeras dosis están destinadas a personas mayores de 80 años, empleados del sector salud y de hogares de ancianos.
Con información de EFE
Rusia brindaría inteligencia a Irán para atacar fuerzas estadounidenses en Oriente Medio, según The Washington Post
El papa León XIV alerta avance de la extrema derecha en España: “Buscan ganar el voto católico”
China desafía a 3 países de Sudamérica con aranceles del 55% para la exportación de carne vacuna
Ecuador destruye campo de entrenamiento de las FARC con apoyo de Estados Unidos en la frontera con Colombia
Recetas

Tallarines verdes peruanos: receta clásica deliciosa (VIDEO)

Cómo preparar un arroz con pollo tradicional riquísimo (VIDEO)

Sudado de pescado (VIDEO)

Escabeche de pollo receta: fácil y buenazo (VIDEO)
Ofertas

Cineplanet
CINEPLANET: 2 entradas 2D + 2 bebidas grandes + Pop corn gigante. Lunes a Domingo
PRECIO
S/ 47.90
Perulandia
PERULANDIA: FULL DAY + Piscinas + S/. 35 o S/.40 de VALE DE CONSUMO + Perusaurus y más. Según elijas
PRECIO
S/ 59.90
Soho Color Salón & Spa
Alisado Brasilero para todo largo con opción a corte. Elige local
PRECIO
S/ 99.90
La Bistecca
ALMUERZO O CENA BUFFET + Postre + 1 Ice tea de Hierba luisa en sus 4 LOCALES
PRECIO
S/ 85.90


