Moderna inicia la última etapa de su potencial vacuna contra la COVID-19
Es la primera empresa en Estados Unidos en pasar a la etapa III. Se prevé aplicar pruebas con 30.000 voluntarios.
- Científicos canadienses crean un método para convertir orina humana en electricidad: las concentradas serían más efectivas
- Científicos descubren sorprendente registro geológico de 23 millones de años tras perforar 523 metros bajo el hielo antártico
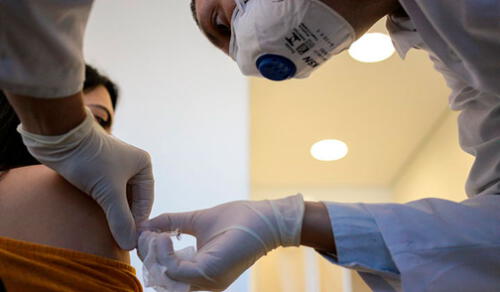
La candidata a vacuna contra la COVID-19 desarrollada por la farmacéutica estadounidense Moderna inició este 27 de julio su tercera y última fase de ensayo. Además, ha logrado duplicar la financiación gubernamental del fármaco hasta 955 millones de dólares, según anunció la empresa en la víspera.
En esta nueva fase se inscribirán un total de 30.000 personas sanas de aproximadamente 89 sitios de todo Estados Unidos. Una mitad recibirá dos inyecciones de la vacuna, mientras que la otra solo recibirá un placebo. Ni ellos ni los médicos sabrán quiénes reciben qué. Se hará un seguimiento constante y se evaluarán los efectos secundarios y efectividad de la vacuna.
Si bien los primeros resultados, en las etapas previas, han demostrado seguridad y que la vacuna estimula inmunidad, la última fase es esencial para confirmar si realmente el fármaco funciona. Según informaron los investigadores, se busca saber si la mRNA-1273 puede prevenir la COVID-19 grave y la muerte o si basta una sola dosis.
En un comunicado, Moderna señaló también que ha modificado su contrato con el organismo BARDA (Biomedical Advanced Research and Development Authority) para que amplíe en 472 millones de dólares la cantidad inicial que iba a destinar al desarrollo de la vacuna.
“Agradecemos a BARDA su continuo compromiso con mRNA-1273, nuestra vacuna candidata contra la COVID-19”, dijo el consejero delegado de Moderna, Stéphane Bancel. Asimismo, señaló los alentadores datos de la fase 1 que llevan a la firma y manifestó que pueden “ayudar a abordar la pandemia” y “prevenir futuros brotes”.
La farmacéutica indicó que podría entregar aproximadamente de 500 a 1.000 millones de dosis por año, a partir de 2021.
Una de las maravillas del mundo antiguo vuelve a la vida: restos del Faro de Alejandría son recuperados desde el fondo del mar
Unos pescadores hacen un descubrimiento que obliga a los científicos a revisar la historia de hace 160 años
Científicos canadienses crean un método para convertir orina humana en electricidad: las concentradas serían más efectivas
Estudio revela que los terremotos podrían ser responsables de la formación de pepitas de oro en la Tierra
Recetas

Tallarines verdes peruanos: receta clásica deliciosa (VIDEO)

Cómo preparar un arroz con pollo tradicional riquísimo (VIDEO)

Sudado de pescado (VIDEO)

Escabeche de pollo receta: fácil y buenazo (VIDEO)
Ofertas

Cineplanet
CINEPLANET: 2 entradas 2D + 2 bebidas grandes + Pop corn gigante. Lunes a Domingo
PRECIO
S/ 47.90
Perulandia
PERULANDIA: FULL DAY + Piscinas + S/. 35 o S/.40 de VALE DE CONSUMO + Perusaurus y más. Según elijas
PRECIO
S/ 59.90
VACILANDIA PARK
VACILANDIA: Full Day + Vale de Consumo. Según elijas ¡DOMINGO 22 LA UNICA TROPICAL!
PRECIO
S/ 29.90
La Bistecca
ALMUERZO O CENA BUFFET + Postre + 1 Ice tea de Hierba luisa en sus 4 LOCALES
PRECIO
S/ 85.90


