Cuestionan calidad de más de 3 millones de pruebas rápidas para detección de COVID-19
Gobierno pagó cerca de S/ 73 millones a una proveedora que nunca antes había tenido una facturación de esa magnitud con el Estado, según informe de Cuarto Poder.
- Reniec habilita duplicado de DNI azul a electrónico desde casa: olvídate de las colas y conoce quiénes pueden hacerlo
- Corte IDH condena al Perú por demorar más de 20 años en cumplir sentencia judicial a favor de jubilado
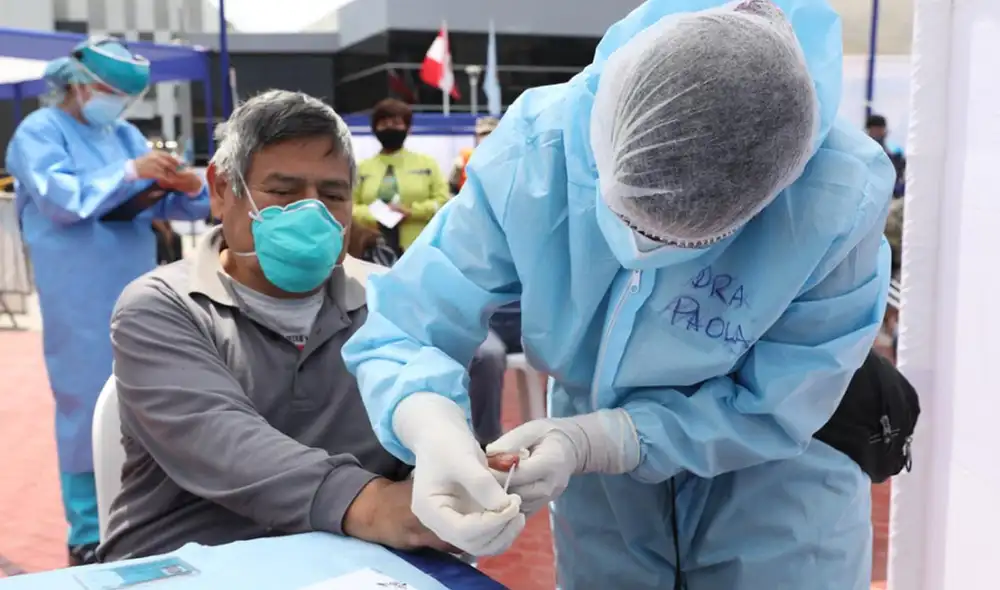
El último 19 de mayo, la Organización Panamericana de la Salud (OPS) cuestionaba, en una conferencia, la efectividad de las pruebas rápidas serológicas para detectar tempranamente la COVID-19 y, refiriéndose al Perú, recomendaba privilegiar las moleculares.
Mientras ello se enfatizaba en Washington, el mismo día, el Instituto Nacional de Salud -uno de los órganos del Ministerio de Salud claves en esta emergencia- le encargaba a la Central de Compras Públicas, Perú Compras, la adquisición de 3 millones y medio de pruebas rápidas de anticuerpos, las mismas que la OPS recomendó utilizar menos.
TE RECOMENDAMOS
MARISEL LINARES EN PROBLEMAS Y DETIENEN A ADRIÁN VILLAR | ARDE TROYA CON JULIANA OXENFORD #FEEG2026
Perú Compras convocó a un proceso y el día 24 de mayo ya tenía un ganador: Deltalab Perú EIRL, que aseguró que traería, en apenas nueve días, la mitad las 3 millones y medio de pruebas desde Corea. Un lapso récord, debido a que aquellos días había restricción de vuelos internacionales.
PUEDES VER: Revisa los candidatos y sus planes de gobierno

Lamentablemente, la calidad de la prueba comprada por el Gobierno ha sido puesta en duda por algunos especialistas.
La compra más costosa de pruebas
De acuerdo a Cuarto Poder, esa fue y sigue siendo la compra más grande de pruebas realizada por el gobierno de Martín Vizcarra, y también la más costosa, ya que el Estado desembolsó S/ 72 438 884 a una proveedora que nunca antes había tenido una facturación de ese calibre con el sector público.
Esta droguería importaba principalmente productos alemanes desde que empezó a funcionar en el 2010.
El producto con el que ganó es la prueba de anticuerpos Standard Q COVID-19 IgM/IgG Combo, del fabricante coreano SD Biosensor. En abril, aproximadamente, Deltalab importó, al parecer para privados, otra marca de la misma línea, la Standard Q COVID-19 IgM/IgG Dúo Test, un producto que la agencia norteamericana de fármacos, FDA, ha vetado.
El subjefe del Instituto Nacional de Salud, Víctor Suárez, admite que la empresa presentó el certificado de una ISO 13485, que garantiza que el productor cumple con esta norma de calidad para la producción de dispositivos médicos. Es decir, garantiza la calidad de proceso más no del producto.
El INS y Perú Compras exigían que la prueba tuviera un mínimo de sensibilidad a los anticuerpos de 91%, y de especificidad al 96%.
Para demostrar que sus valores eran más altos que lo exigido, Deltalab presentó en su propuesta una ficha técnica del producto, con una tabla que indicaba una sensibilidad de 96,94%, y una especificidad de 96%. Esta información también fue presentada al INS.
Sin embargo, no contenía el panorama completo, según el programa periodístico. Esos valores aparecen recién, de acuerdo al mismo documento, después de 14 días de aparecidos los síntomas de la COVID-19, es decir, al iniciar la tercera semana de los primeros síntomas, cuando el paciente, probablemente, ya ha contagiado a más personas.
En el inserto original del fabricante Biosensor muestra que en los primeros 7 días, la sensibilidad de esta prueba es de 69,05%; y entre el sétimo y el décimo cuarto día de contagio, un 89,39%. Es decir, mucho menos que lo exigido en las bases.
Desafortunadamente, este es un hecho muy importante porque estas pruebas son y han sido las protagonistas de la política de detección ‘temprana’ de la COVID-19.
“Si yo recién empiezo a medir después del día 14, me voy a perder muchos que arrancan su respuesta inmune tarde, que justamente son los gravemente enfermos, quienes no empiezan su respuesta inmune temprano”, señala Ernesto Bustamante, biólogo molecular y exjefe del INS.
PUEDES VER: CDC al INS: historia de un traspaso inconcluso pese a la urgencia de la vigilancia epidemiológica
Cuarto Poder consultó al gerente general de Deltalab, Mario Ossio Dávila, la razón por la que no entregaron a Perú Compras el inserto como el de fábrica y este respondió que sí entregaron un inserto remitido por el fabricante coreano, y que lo ocurrido se debe a que la ficha es constantemente actualizada, de acuerdo al momento en que se toman las muestras.
“Varias personas andan insistiendo que estas pruebas, para detectar casos activos, no es tan buena”, indica el epidemiólogo e investigador de la Universidad Peruana Cayetano Heredia, César Ugarte. “[El paciente] contagia, puede estar contagiando, puede empeorar, puede ser asintomático, algunos no lo sabemos”, añadió.
Una vez que las pruebas coreanas estuvieron en suelo peruano, el INS sometió a análisis de laboratorio un pequeño lote para probar su efectividad en sesenta muestras de sangre, treinta positivas, confirmadas con prueba molecular, y treinta negativas.
La coreana Stándar Q Combo arrojó valores muy altos, por lo que el INS concluyó que, entonces, su sensibilidad y especificidad eran del 100%. Según la entidad, las muestras de sangre eran de pacientes en el sétimo día de síntomas. Cuarto Poder solicitó el protocolo de esa prueba, pero solo les entregaron un reporte con los resultados.
Acerca de la muestra de prueba de efectividad, el investigador Edward Málaga señala que están en el límite del mínimo. “Si esa fuera la única evaluación disponible, me parece que sería muy poco”, señaló.
“¿Cuánto es una muestra de 60? Una muestra de 60 es, más o menos, dos puntos porcentuales. Es decir, solamente con tener una muestra fuera de la norma, y eso puede ser atribuible a tantas cosas en una muestra tan pequeña, ya me daría no 98%, sino 96%", explica Ernesto Bustamante, exjefe del INS.
Desde que estas pruebas llegaron al país, en la quincena de junio, se han usado masivamente en el testeo de todo sospechoso de estar infectado con el SARS-CoV-2, pero también en el personal médico y en adultos mayores, que no se caracterizan, estos últimos, por manifestar los anticuerpos suficientes que esta prueba debería detectar. Tres meses y medio después de su compra, solo quedan 300.000.
Recién esta semana, luego de seis meses de pandemia, Perú Compras acaba de cerrar la compra de otras 500.000 pruebas moleculares. Con eso, el Perú tendría su primer millón de pruebas moleculares. El problema es que terminarán de llegar en diciembre.
Dicen los expertos que los S/ 107 millones que pagó el gobierno por las 5 200 000 pruebas rápidas pudo haber financiado diversos proyectos nacionales de prueba molecular, incluyendo a varios laboratorios.
Coronavirus en Perú, últimas noticias:




















