Digemid autoriza el tratamiento con Regkirona para pacientes con COVID-19
En la resolución directoral se menciona que ya se aprobó dicho medicamento elaborado en Corea del Sur para tratar el coronavirus. Esta autorización de registro sanitario condicional se ha dado por el plazo de un año.
- Carreteras bloqueadas por fuertes lluvias en Perú: revisa las vías con tránsito interrumpido y restringido, según Sutran
- Apagón masivo en Lima Este: globo metálico dejó sin electricidad a más de 47.000 familias
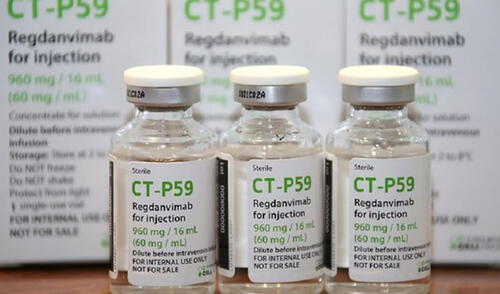
La Dirección General de Medicamentos Insumos y Drogas (Digemid) autorizó el ingreso del medicamento Regkirona (regdanvimab), elaborado por la biofarmacéutica surcoreana Celltrion. Según el documento de la Resolución Directoral n° 13120-2021, esto será para el tratamiento de pacientes con coronavirus.
El registro sanitario condicional fue autorizado el último 16 de noviembre y vencerá en la misma fecha del 2022. El medicamento solo se venderá bajo una receta médica y aún se desconoce la llegada del producto. De acuerdo a fuentes del Digemid a La República, el laboratorio Celltrion ya fue notificado y solo faltaría que traigan el fármaco para que Perú ya cuente con este tratamiento.
TE RECOMENDAMOS
¿JAQUE MATE A JERÍ? EL CONGRESO LO CENSURA | ARDE TROYA CON JULIANA OXENFORD #FEEG2026
PUEDES VER: Revisa los candidatos y sus planes de gobierno

“Autorizar con el número BEC-0008 la inscripción en el registro sanitario condicional del producto biológico extranjero: REGKIRONA 960 mg/16ml concentrado para solución para perfusión, caja de cartón con 01 vial de vidrio tipo I incoloro x 16 ml de concentrado para solución para perfusión, para venta con receta médica”, se lee en su artículo 1.
PUEDES VER: UNFV Admisión 2021 EN VIVO: últimas noticias del examen presencial este sábado 20 de noviembre
Así también, Digemid precisó que la farmacéutica deberá presentar ciertos documentaciones y el avance del medicamento durante el 2022. Si no se cumple con dichas obligaciones tal como se menciona, la institución procederá a la suspensión o cancelación del registro sanitario correspondiente.
Resolución del Digemid.
La EMA aprobó los tratamientos con Regkirona
La Agencia Europea del Medicamento (EMA) respaldó el uso de tratamientos de anticuerpos monoclonales para pacientes con COVID-19 con el medicamento Regkirona. Por ello, se recomendó su autorización de comercialización en la Unión Europea (UE).
Esta medicina permite reducir la capacidad del virus de llegar a las células del cuerpo. Con ello, se reduciría la hospitalización de los pacientes con el coronavirus.
Cierran carril de vía expresa Línea Amarilla: tránsito restringido desde Puente Ejército hacia Lima por rescate en río Rímac
Nueva Carretera Central sigue en construcción: megaproyecto iniciará con túnel Pariachi por más de S/2 millones este 2026
Las tres mejores universidades del Perú, según World University Rankings 2026: el primer lugar obtuvo 60 puntos en calidad de investigación
Recetas

Tallarines verdes peruanos: receta clásica deliciosa (VIDEO)

Cómo preparar un arroz con pollo tradicional riquísimo (VIDEO)

Sudado de pescado (VIDEO)

Escabeche de pollo receta: fácil y buenazo (VIDEO)
Ofertas

Cineplanet
CINEPLANET: 2 entradas 2D + 2 bebidas grandes + Pop corn gigante. Lunes a Domingo
PRECIO
S/ 47.90
Perulandia
PERULANDIA: FULL DAY + Piscinas + S/. 35 o S/.40 de VALE DE CONSUMO + Perusaurus y más. Según elijas
PRECIO
S/ 59.90
VACILANDIA PARK
VACILANDIA: Full Day + Vale de Consumo. Según elijas ¡DOMINGO 22 LA UNICA TROPICAL!
PRECIO
S/ 29.90
La Bistecca
ALMUERZO O CENA BUFFET + Postre + 1 Ice tea de Hierba luisa en sus 4 LOCALES
PRECIO
S/ 85.90


