Vacuna de Pfizer es segura contra COVID-19 y protege desde la primera dosis, dice FDA
“Las personas previamente infectadas pueden estar en riesgo de contraer COVID-19 y podrían beneficiarse de la vacuna”, dijo la FDA. Ahora EE. UU. se sumaría a la vacunación.
- Así extraerán del océano el primer cable transatlántico de fibra óptica para construir nuevas redes submarinas
- Ataque de EE.UU. e Israel contra Irán HOY, EN VIVO: últimas noticias, nuevas ofensivas, posible participación de Europa en la guerra y más
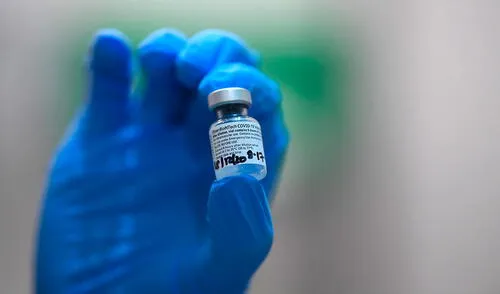
La Agencia de Alimentos y Medicamentos de Estados Unidos (FDA, por su sigla en inglés) confirmó este martes 8 de diciembre la seguridad y eficacia de la vacuna de la COVID-19 de Pfizer y BioNTech en un primer análisis previo a su autorización, con lo que apuntó que podría comenzarse la vacunación en el país en los próximos días.
En su análisis, la FDA señaló que la vacuna, la primera considerada para distribución en Estados Unidos, cumplía “con los criterios de éxito prescritos” en un estudio clínico.
TE RECOMENDAMOS
REGISTROS AKÁSHICOS Y VIDAS PASADAS: LOS SECRETOS QUE GUARDA TU ALMA | ASTROMOOD CON JHAN SANDOVAL
El reporte señala que la vacuna, que necesita dos dosis, garantiza “la reducción de riesgo de COVID-19 confirmado al menos siete días después de la dosis 2” y “una reducción del riesgo de COVID-19 confirmado grave en cualquier momento tras la dosis 1”.
El índice de eficacia es del 95% en general y del 94% entre mayores de 65 años (población de riesgo), y por lo tanto es muy superior al 50% que exige la FDA para aprobar candidatas a vacunas contra el coronavirus SARS-CoV-2.
Este jueves, un organismo independiente científico revisará estos resultados, y de concordar con la FDA, abriría la posibilidad de comenzar la distribución este fin de semana.
El Reino Unido comenzó este martes a suministrar las primeras dosis de la vacuna de Pfizer y BioNTech para la inmunización de la población.
La vacunación puede beneficiar a las personas previamente infectadas con coronavirus, añadió la Administración de Medicamentos y Alimentos.
Principales desarrollos en la elaboración de la vacuna de Pfizer-BioNTech. Infografía: AFP
“Las personas previamente infectadas pueden estar en riesgo de contraer la COVID-19 y podrían beneficiarse de la vacuna”, dijo la FDA.
La FDA afirmó que solo el 3% de los participantes en los ensayos de Pfizer y BionTech tenían evidencia de infección previa en el momento de la inscripción en el estudio y aseguró que los análisis adicionales mostraron que muy pocos casos de la COVID-19 ocurrieron en estos participantes durante el transcurso de todo el estudio.
Con información de EFE y Sputnik
Gobierno de Trump confirma que submarino de Estados Unidos hundió buque de guerra iraní en océano Índico
EE. UU. e Israel atacan edificio del organismo encargado de elegir al nuevo líder supremo de Irán
El líder venezolano Edmundo González anuncia que será sometido a una intervención por un "hueso roto"
Ataque de EE.UU. e Israel contra Irán, EN VIVO: israelíes atacan un objetivo de Hezbolá mientras España insiste en no apoyar la guerra
Recetas

Tallarines verdes peruanos: receta clásica deliciosa (VIDEO)

Cómo preparar un arroz con pollo tradicional riquísimo (VIDEO)

Sudado de pescado (VIDEO)

Escabeche de pollo receta: fácil y buenazo (VIDEO)
Ofertas

Cineplanet
CINEPLANET: 2 entradas 2D + 2 bebidas grandes + Pop corn gigante. Lunes a Domingo
PRECIO
S/ 47.90
Perulandia
PERULANDIA: FULL DAY + Piscinas + S/. 35 o S/.40 de VALE DE CONSUMO + Perusaurus y más. Según elijas
PRECIO
S/ 59.90
Soho Color Salón & Spa
Alisado Brasilero para todo largo con opción a corte. Elige local
PRECIO
S/ 99.90
La Bistecca
ALMUERZO O CENA BUFFET + Postre + 1 Ice tea de Hierba luisa en sus 4 LOCALES
PRECIO
S/ 85.90


