EE. UU. autoriza nueva versión de vacunas de Pfizer y Moderna para la variante ómicron
Los 2 inmunizantes actualizados fueron aprobados para una dosis de refuerzo: la de Pfizer a partir de los 12 años y la de Moderna desde los 18, señaló la agencia de medicamentos.
- Autoridades de Colombia ordenan retirar más de 100 marcas de esmalte de uñas por posibles riesgos sanitarios
- Así extraerán del océano el primer cable transatlántico de fibra óptica para construir nuevas redes submarinas
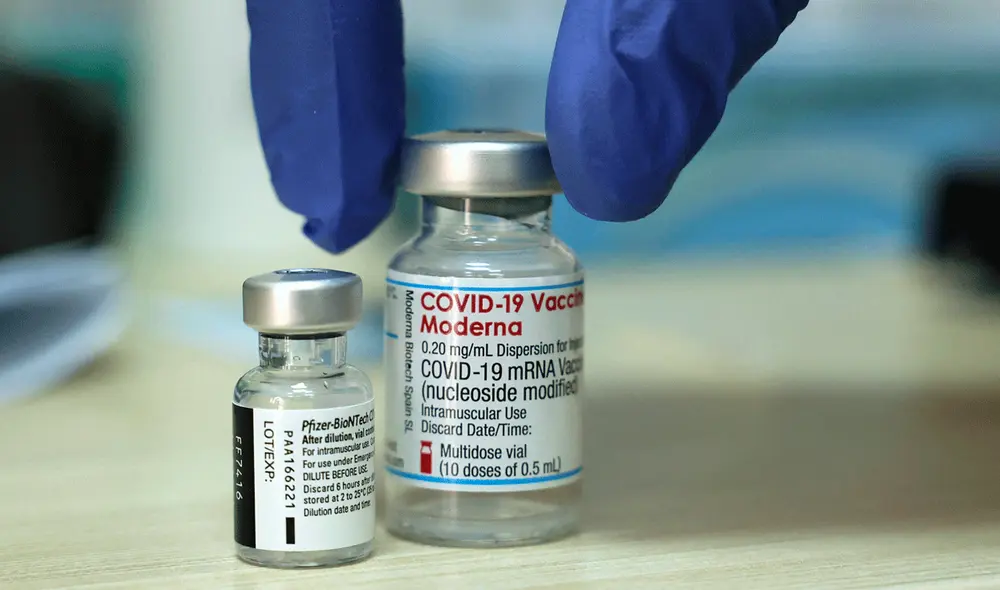
Las autoridades sanitarias de Estados Unidos aprobaron este miércoles 31 de agosto la nueva versión de las vacunas anti-COVID-19 de Pfizer y Moderna para la variante ómicron con miras a contener una posible ola de contagios en otoño e invierno.
Las dos vacunas actualizadas fueron autorizadas para una dosis de refuerzo, a partir de los 12 años la de Pfizer y a partir de los 18 la de Moderna, indicó la agencia de medicamentos estadounidense, la FDA, en un comunicado.
TE RECOMENDAMOS
TIPOS DE MAGIA: BLANCA, NEGRA Y ROJA — MITOS, RIESGOS Y VERDADES | ASTROMOOD CON JHAN SANDOVAL
La nueva generación de vacunas se dirige tanto a la cepa original de la COVID-19 como a las subvariantes BA.4 y BA.5 de ómicron. Este último linaje representa casi el 90% de las infecciones en Estados Unidos.
PUEDES VER: Revista Time respalda a Boric: “Presidente de Chile es un nuevo tipo de líder de izquierda”
Por tanto, deberían “brindar una mayor protección contra la variante ómicron que circula actualmente”, escribió la entidad.
“Se espera una nueva oleada cuando pasemos más tiempo dentro de casa este otoño e invierno”, advirtió el jefe de la FDA, Robert Califf, en una rueda de prensa, en la que aseguró que se “anticipa” ese aumento de la contaminación.
A principios del verano, el Departamento de Salud de Estados Unidos anunció que había comprado 105 millones de dosis de Pfizer y 66 millones de Moderna para usar durante el otoño y el invierno boreal.
Las vacunas aún no han sido recomendadas por los Centros para el Control y la Prevención de Enfermedades (CDC), la principal agencia de salud pública estadounidense.
PUEDES VER: “El mundo los mira como un modelo”: Mark Ruffalo llama a aprobar nueva constitución de Chile
Los CDC convocaron a un comité de expertos independientes para discutir el tema el jueves. Tras realizar esas consultas, la directora de la agencia, Rochelle Walensky, será la encargada de darle la luz verde definitiva.
Esta nueva versión de los inmunizantes podría estar disponible la próxima semana en el país. Las vacunas que circulan actualmente fueron concebidas para proteger de la cepa inicial del virus, que fue reportado por primera vez a fines de 2019 en Wuhan, China.
Sin embargo, poco a poco se han ido mostrando menos eficaces frente a las variantes que fueron apareciendo con el tiempo, debido a la rápida evolución del virus.
A diferencia de las variantes alfa y delta, que finalmente cedieron, ómicron y sus subvariantes han dominado gradualmente los contagios en 2022 en todo el mundo. Pfizer y Moderna también han presentado una solicitud de autorización para esta versión actualizada de su vacuna a la Agencia Europea de Medicamentos (EMA).
“Restaurar la inmunidad”
La inmunización inicial seguirá ofreciéndose con las vacunas anteriores por el momento para proporcionar una “base” de inmunidad, expresó Califf.
Las dosis de refuerzo pueden administrarse a partir de dos meses después de recibir una anterior (de refuerzo o de vacunación inicial). Cada una es de 30 microgramos para Pfizer y de 50 microgramos para Moderna.
“La esperanza es ‘restaurar’ un nivel de inmunidad similar al que daban las vacunas en cuando se introdujeron y proporcionar una ‘mayor duración de la protección’ para que los refuerzos no tengan que repetirse con mucha frecuencia”, sostuvo Peter Marks de la FDA.
Preguntado sobre incluir a la población joven en esta campaña de refuerzo, Marks señaló que estas vacunas podrían ayudar a proteger contra el llamado “COVID long”, que afecta a todas las edades.






















