Un científico corrige un error de Einstein de hace 120 años al unificar principios clave de la termodinámica
Un físico español ha resuelto un dilema científico de más de un siglo al unificar dos principios fundamentales de la termodinámica.
- Científicos españoles logran convertir colillas de cigarrillos en asfalto para pistas y carreteras más duraderas: China apoyó
- Sorpresa en la comunidad científica: nace la primera cría en libertad de un animal desaparecido de su hábitat tras más de 100 años
Durante más de un siglo, existió una contradicción en las leyes fundamentales de la física que permanece sin resolver. Se trata del teorema de Nernst, una regla empírica que describe como la entropía, una medida del desorden, tiende a desaparecer cuando la temperatura se aproxima al cero absoluto.
Se trata de una ley tan profundamente arraigada que incluso Albert Einstein llegó a cuestionar su conexión con un teorema debatido en 1905, al que pocos científicos se habían atrevido a contradecir. Hasta ahora. José María Martín Olalla, profesor de la Universidad de Sevilla, publicó un informe que revela un enigma científico de más de un siglo.
Teorema de Nernst: el misterio científico sin resolver desde 1905
En 1905, el químico Walther Nernst formuló un teorema que, en pocas palabras, decía que la variación de entropía tiende a cero cuando la temperatura también lo hace. Una observación empírica, respaldado por experimentos a temperaturas cercanas al cero absoluto, y se convirtió en uno de los pilares de la termodinámica.
Para sostenerlo, ideó un razonamiento por contradicción: si el cero absoluto fuese accesible, sería posible construir una máquina que convierta todo el calor en trabajo, violando asó el segundo principio.
Einstein no lo aceptó. Consideraba que los razonamientos basados en "máquinas imposibles" carecían de validez universal, por lo que propuso establecer un tercer principio de la termodinámica como base independiente. Desde entonces, el teorema de Nernst fue marginado y clasificado como un caso especial y objeto de debate, hasta la publicación del trabajo de Martín Olalla.
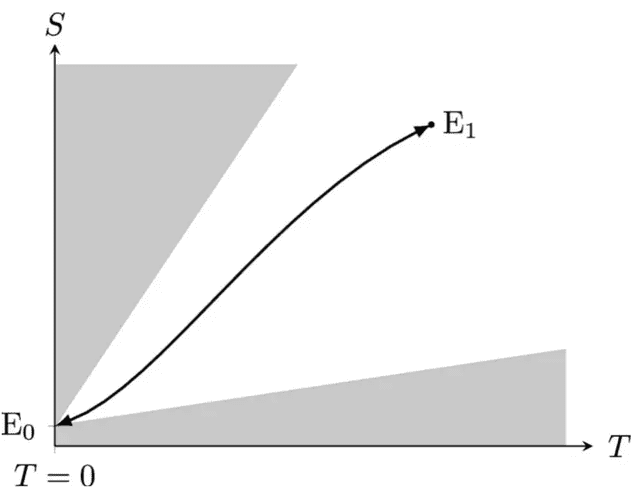
Una máquina de Carnot reversible que opere a temperatura cero solo puede concebirse como un ciclo teórico cerrado entre dos estados de equilibrio Foto: The European Physical Journal Plus
José María Martín Olalla, profesor de la Universidad de Sevilla, quien ha publicado su revolucionaria investigación en The European Physical Journal Plus. Su trabajo no solo resuelve una disputa científica de más de 100 años, sino que reordena de forma elegante y lógica la base conceptual de la física clásica.
Olalla replantea el problema sin utilizar argumentos por contradicción. Se apoya en el funcionamiento teórico de una máquina de Carnot, ideal u reversible, que opera entre dos temperaturas, una de ellas igual a cero. Según el segundo principio, ninguna máquina puede extraer calor útil de un depósito a T=0. Y si no puede hacerlo, no puede tampoco generar trabajo.
Esto lleva directamente a la conclusión de que la variación de entropía en ese proceso debe ser desde cero. Como él escribe en el artículo: “cada (∆S)T a T = 0 debe ser cero para todo cuerpo de densidad finita, independientemente del cambio en su configuración”.
Las implicaciones para la ciencia y la enseñanza
La nueva demostración no solo resuelve una paradoja histórica, sino que también influye en la comprensión formal del cero absoluto y en la naturaleza de la entropía. Esta perspectiva resulta crucial en áreas como la física cuántica, la materia condensada o la criogenia, donde los fenómenos a temperaturas extremas determinan el comportamiento de los sistemas.
En el ámbito educativo, Martín Olalla indica que sus propios estudiantes fueron los primeros en conocer esta nueva interpretación. Su objetivo actual es ampliar la difusión de esta visión en la comunidad académica internacional y cuestionar la “gran inercia” que aún sostiene el paradigma de los tres principios.