Coronavirus: vacuna china de Sinopharm en su hora cero con la OMS
Revisión. La Organización Mundial de la Salud a punto de decidir su autorización. Según Minsa, resultado servirá de respaldo, mas no será vinculante para su uso local. Laboratorio aún no lo ha solicitado en el Perú. Digemid aprueba nuevo registro de Pfizer.
- Escolar de 14 años logra puntaje de ingreso a la UNI, pero no podrá ocupar la vacante
- Con 17 años, joven de Junín obtiene el primer puesto en Ingeniería de Sistemas en la UNI tras prepararse menos de dos meses
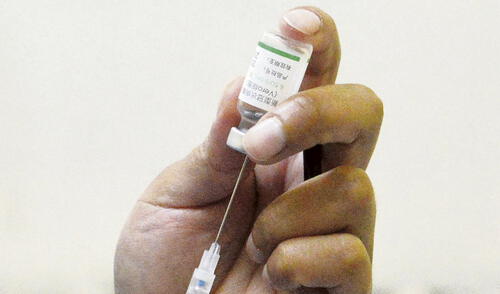
La Organización Mundial de la Salud (OMS) tiene previsto decidir, entre hoy o mañana, si autorizará el uso en emergencia de la vacuna del laboratorio chino Sinopharm, el cual participó en un polémico ensayo clínico en el Perú en 2020 y envió un primer lote de un millón de dosis en febrero pasado.
Ese plazo estimado (fines de abril) es el que figura en el último reporte del organismo internacional, cuyo Grupo de Expertos en Asesoramiento Estratégico sobre Inmunización (SAGE, por sus siglas en inglés) sostuvo ayer una reunión extraordinaria para presentar los datos clínicos de los estudios en fase 1, 2, y 3 sobre seguridad y eficacia, así como para dar a conocer su proyecto de recomendación sobre el uso de esta vacuna. Este mismo proceso lo han concluido —y superado— las compañías Pfizer/BioNTech, AstraZeneca y Janssen (Johnson & Johnson).
TE RECOMENDAMOS
¡RENUNCIA EN EL CASO MARZANO! Y LÓPEZ ALIAGA SE DESPLOMA | ARDE TROYA CON JULIANA OXENFORD #FEEG2026
PUEDES VER: Revisa los candidatos y sus planes de gobierno

Si Sinopharm logra su inclusión en esta lista de uso de emergencias de la OMS, se cumplirá un requisito previo para el suministro de estas vacunas a través del mecanismo Covax, el cual hasta el momento solo ha enviado al Perú dosis de AstraZeneca y Pfizer. Además, precisa el organismo internacional, estas autorizaciones permiten a los países acelerar su propia aprobación regulatoria para importar y administrar las vacunas contra el nuevo coronavirus.
No obstante, fuentes del Minsa precisaron que si bien una eventual aprobación de la OMS serviría de respaldo en la evaluación de la Dirección General de Medicamentos, Insumos y Drogas (Digemid), esto no es vinculante en la negociación bilateral. “Los países adscritos a Covax comparten información, hay un acuerdo de confidencialidad. Si envía la vacuna china, es probable que la autorización excepcional se apruebe casi automáticamente. Pero solo en ese caso. En otros se seguirá exigiendo el marco regulatorio”.
Hasta el momento, la Digemid ha emitido un certificado de buenas prácticas de manufactura a Sinopharm. Esto representaría un avance del 80% para su registro sanitario condicional en el Perú, lo que permitiría el ingreso de nuevos lotes de este producto. Sin embargo, según fuentes del Minsa, ni el laboratorio ni su representante legal han presentado la solicitud para su autorización.
Sinopharm, por su parte, ofreció hace una semana enviar un lote de medio millón de dosis. “Pero siguen las conversaciones para retomar lo que en su momento fue un ofrecimiento mayor”, aseguró el ministro de Salud, Óscar Ugarte.
Por otro lado, la Digemid autorizó ayer el registro sanitario condicional de la vacuna Comirnaty, desarrollada por Pfizer/BioNTech ya no en Bélgica, sino en Kalamazoo, Estados Unidos.
Palabra de la OPS
Al cierre de esta edición, aún no se conocía una decisión de la OMS sobre Sinopharm. No obstante, consultado por La República, el jefe de inmunizaciones de la Organización Panamericana de la Salud (OPS), Cuauhtemoc Ruiz, precisó que para que se dé esta recomendación del uso de vacuna se requieren dos situaciones: la primera, la autorización del uso de emergencia; y la segunda, la recomendación del uso por parte del grupo de expertos de enfermedades prevenibles por vacunación.
“Cuando se dan ambas cosas, entonces surge la recomendación, en la que se precisa a qué grupo de edad se debe vacunar, qué dosis, cómo debe conservarse. Todo eso se analiza y se recomienda”, dijo.
Voluntarios interpondrán denuncia penal
Cientos de voluntarios del ensayo clínico de Sinopharm, que estuvo inmerso en el escándalo del vacunagate, denuncian que aún no hay una fecha exacta para el levantamiento del ciego ni se ha inoculado la segunda dosis al personal de salud.
Por eso, detalla su representante, Pedro Ponce, la próxima semana interpondrán acciones legales contra las autoridades de la Universidad Cayetano Heredia, los responsables del estudio y autoridades del Gobierno. El delito sería contra la vida el cuerpo y la salud, en la modalidad de exposición al peligro.
Según el INS, para que ingresen las vacunas de los voluntarios, faltan solicitudes de UPCH y el paso por Digemid. La UPCH ha dicho que falta respuesta del INS.
Newsletter COVID-19 en Perú de La República
Suscríbete aquí al boletín de La República y recibe a diario en tu correo electrónico toda la información sobre el estado de emergencia y la pandemia de la COVID-19.
Con 17 años, joven de Junín obtiene el primer puesto en Ingeniería de Sistemas en la UNI tras prepararse menos de dos meses
Joven de 18 años de VMT logra primer lugar en Ingeniería Civil en la UNI y rompe tradición familiar: “Quería dar un paso diferente”
Hallan cuerpo de Marleni Rucana, la suboficial PNP desaparecida en Áncash: su colega confesó el crimen
Recetas

Tallarines verdes peruanos: receta clásica deliciosa (VIDEO)

Cómo preparar un arroz con pollo tradicional riquísimo (VIDEO)

Sudado de pescado (VIDEO)

Escabeche de pollo receta: fácil y buenazo (VIDEO)
Ofertas

Cineplanet
CINEPLANET: 2 entradas 2D + 2 bebidas grandes + Pop corn gigante. Lunes a Domingo
PRECIO
S/ 47.90
Perulandia
PERULANDIA: FULL DAY + Piscinas + S/. 35 o S/.40 de VALE DE CONSUMO + Perusaurus y más. Según elijas
PRECIO
S/ 59.90
VACILANDIA PARK
VACILANDIA: Full Day + Vale de Consumo. Según elijas
PRECIO
S/ 29.90
La Bistecca
ALMUERZO O CENA BUFFET + Postre + 1 Ice tea de Hierba luisa en sus 4 LOCALES
PRECIO
S/ 85.90


