“Podríamos considerarlo adecuado”: EE. UU. evalúa usar una vacuna antes de que termine la fase III
El Gobierno no descarta aprobar el uso de emergencia de una vacuna contra la COVID-19 “si el beneficio es muy superior al riesgo en medio de una emergencia sanitaria”.
- Irán responde al ataque con misiles a Israel y bases militares de EE.UU. en Medio Oriente: "Ahora estamos más preparados que nunca"
- EE.UU. e Israel atacan Irán HOY, EN VIVO: cifra de muertos, imágenes y últimas noticias sobre la ofensiva en Medio Oriente
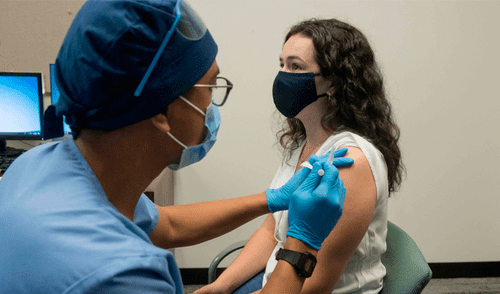
El comisario de la Administración de Alimentación y Medicamentos de Estados Unidos (FDA), Stephen Hahn, no descarta autorizar el uso de emergencia de una vacuna contra el coronavirus antes de que termine la fase III de ensayos.
“Dependerá del desarrollador si solicita una autorización y después se emite una autorización para su uso”, sostuvo Hahn durante una entrevista con el Financial Times. “Si lo hacen antes de terminar la fase 3 podríamos considerarlo adecuado, o no. Entonces decidiremos”, señaló.
TE RECOMENDAMOS
REIKI: QUÉ ES, CÓMO FUNCIONA Y SUS BENEFICIOS EN LA SANACIÓN ENERGÉTICA |ASTROMOOD CON JHAN SANDOVAL
PUEDES VER: Rusia planea iniciar vacunación masiva a grupos de riesgo después de noviembre o diciembre
El funcionario dejó en claro que no se trata de una presión del gobierno de Donald Trump para concretar una estrategia política. “La pandemia de la COVID-19 coincide con las elecciones y vamos a tener que superarlo y ceñirnos a nuestros principios”.
Añadió que “el criterio legal, médico y científico es si el beneficio es muy superior al riesgo en medio de una emergencia sanitaria”.
El presidente estadounidense, Donal Trump, junto al jefe de la FDA, Stephen Hahn, en la Casa Blanca. Foto: CNP / Stefani Reynolds
Al respecto, el director del Instituto Nacional de Alergias y Enfermedades infecciosas, Anthony Fauci, advirtió que la polémica iniciativa de emergencia conllevaría riesgos en la salud de las personas.
“Lo único que no le gustaría ver con una vacuna es obtener una EUA (sigla en inglés para autorización de uso de emergencia) antes de tener una señal de eficacia”, señaló Fauci a Reuters.
“Uno de los peligros potenciales si deja salir una vacuna prematuramente es que haría difícil, si no imposible, que las otras vacunas inscribieran a las personas en sus ensayos”, sostuvo.
Según la guía de la FDA sobre las vacunas, la aprobación total para una EUA requiere una demostración explícita de que es segura y efectiva. Hasta el momento, son dos vacunas estadounidenses que están en la fase 3, la de Moderna y la de Pfizer/BioNTech, y dos más lo harán a mediados de setiembre.
Irán desafía a Trump y promete vengar muerte de Alí Jamenei: "Atacaremos con una fuerza que jamás han conocido"
Donald Trump confirma la muerte de Alí Jamenei, ayatolá y líder supremo de Irán tras ataque de Israel
Argentina y Uruguay se convierten en los primeros países del Mercosur en ratificar el acuerdo comercial con la UE
Irán responde al ataque con misiles a Israel y bases militares de EE.UU. en Medio Oriente: "Ahora estamos más preparados que nunca"
Recetas

Tallarines verdes peruanos: receta clásica deliciosa (VIDEO)

Cómo preparar un arroz con pollo tradicional riquísimo (VIDEO)

Sudado de pescado (VIDEO)

Escabeche de pollo receta: fácil y buenazo (VIDEO)
Ofertas

Cineplanet
CINEPLANET: 2 entradas 2D + 2 bebidas grandes + Pop corn gigante. Lunes a Domingo
PRECIO
S/ 47.90
Perulandia
PERULANDIA: FULL DAY + Piscinas + S/. 35 o S/.40 de VALE DE CONSUMO + Perusaurus y más. Según elijas
PRECIO
S/ 59.90
VACILANDIA PARK
VACILANDIA: Full Day + Vale de Consumo. Según elijas
PRECIO
S/ 29.90
La Bistecca
ALMUERZO O CENA BUFFET + Postre + 1 Ice tea de Hierba luisa en sus 4 LOCALES
PRECIO
S/ 85.90


