COVID-19: vacuna de Moderna es segura y eficaz en niños de 6 meses a 5 años, anuncia compañía
Con solo la cuarta parte de la dosis normal, los niños desarrollaron la misma cantidad de anticuerpos que los jóvenes de 18 a 25 años. Ahora solicitarán autorización para su uso.
- Científicos suizos podrían cambiar el futuro de la electrónica cuántica con circuitos controlados por luz
- La 'fruta milagrosa' que crece en América Latina, transforma sabores y es clave para pacientes con cáncer en Estados Unidos
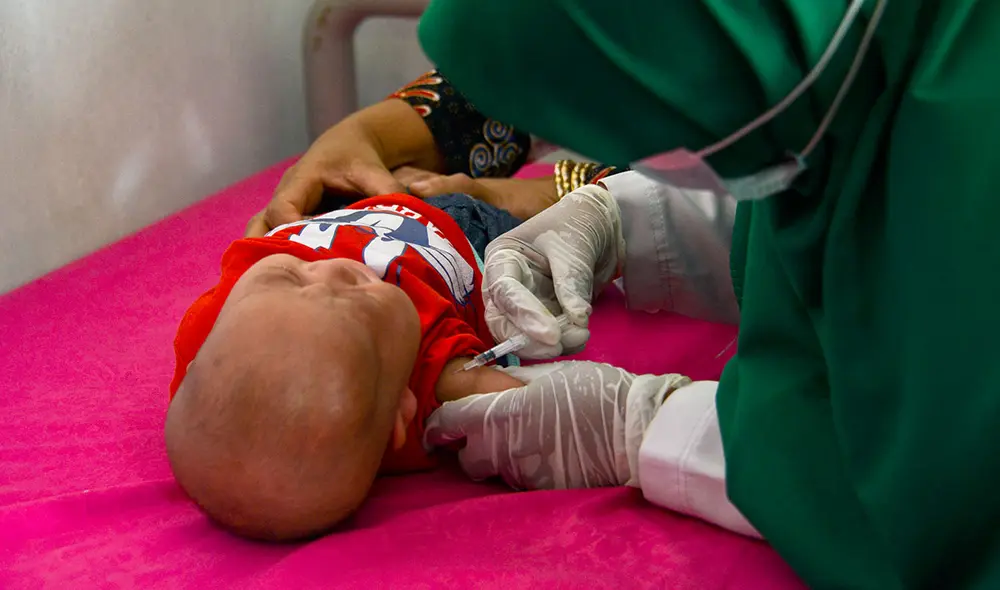
La empresa de biotecnología estadounidense Moderna dijo, este miércoles, que pedirá la aprobación de su vacuna contra la COVID-19 en niños de 6 meses a 5 años después de que los ensayos demostraran que es segura y genera una fuerte respuesta inmunitaria.
Dos dosis de 25 microgramos administradas a niños de esta franja etaria produjeron niveles de anticuerpos similares a los niveles alcanzados por dos dosis de 100 microgramos en jóvenes de 18 a 25 años.
Sobre la base de estos datos, Moderna manifestó que en las próximas semanas presentará solicitudes de autorización a la Agencia de Medicamentos de Estados Unidos (FDA), la Agencia Europea de Medicamentos (EMA) y otros reguladores.
Los resultados “son buenas noticias para los padres de niños menores de 6 años”, dijo el director ejecutivo de Moderna, Stephane Bancel, en un comunicado. “Ahora tenemos datos clínicos sobre el rendimiento de nuestra vacuna en niños de 6 meses hasta en adultos mayores”.
La compañía, sin embargo, registró una eficacia relativamente baja de la vacuna respecto a los contagios en sus ensayos, que se llevaron a cabo durante la ola de la variante ómicron.
La efectividad de la vacuna en niños de 6 meses a 2 años fue del 43,7%, y del 37,5% en los de 2 a 5 años.
Moderna, que afirmó que estos niveles son similares a los observados en adultos, está evaluando una tercera dosis para incrementarlos.
El ensayo involucró a 11.700 niños en Estados Unidos y Canadá, 4.200 de ellos con edades de entre 2 y 6 años y 2.500, de entre 6 meses y 2 años.
Moderna agregó que, tras consultar con la FDA, también pedirá la aprobación de dos dosis de 50 microgramos en niños de 6 a 11 años, y actualizará su solicitud de autorización para adolescentes de 12 a 17 años.
La EMA y otros reguladores ya han autorizado la vacuna de Moderna en estos grupos.
En febrero de este año, la FDA postergó sus debates sobre la licencia de la vacuna de Pfizer-BioNTech para menores de 5 años tras argumentar que necesitaba datos adicionales sobre la tercera dosis. Las compañías dijeron que esperan que esos datos estén listos para abril.





















