“Es crucial para la entrada del virus”: descubren un nuevo punto débil del SARS-CoV-2
Los científicos han detectado una nueva zona del virus que permite su ingreso a las células humanas. Ahora diseñan un método para bloquearla.
- Científicos españoles logran convertir colillas de cigarrillos en asfalto para pistas y carreteras más duraderas: China apoyó
- Sorpresa en la comunidad científica: nace la primera cría en libertad de un animal desaparecido de su hábitat tras más de 100 años
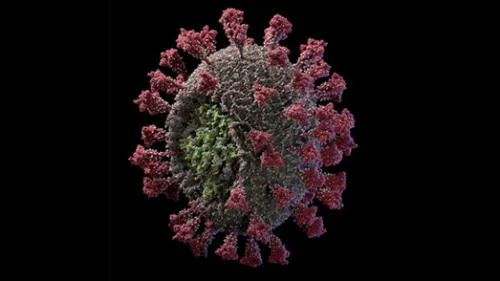
El coronavirus SARS-CoV-2, responsable de la actual pandemia, es conocido por tener en su superficie unas espículas que le dan el aspecto de una corona. Cada una de esas ‘púas’ contiene la proteína S, aquella molécula que le permite al virus ingresar a las células humanas e infectarlas. Pero estas armas virales no actúan solas, según el reciente hallazgo de un equipo de investigadores de la Universidad del Noroeste (Estados Unidos).
Los científicos hicieron simulaciones de la proteína S y detectaron una región llamada sitio de escisión polibásico. Esta se encuentra a una distancia de 10 nanómetros (un nanómetro es la millonésima parte de un milímetro) de la zona de reconocimiento de la proteína S, donde la espícula de virus se une a la enzima ACE2, la puerta de entrada a la célula humana.
Su análisis determinó que esta escisión, que posee carga positiva, asegura la unión entre la proteína S y los receptores de las células humanas, de carga negativa. Debido a la polaridad química, las moléculas con cargas eléctricas opuestas se atraen.
Tres sitios de escisión identificados en la proteína S. Crédito: Baofu Qiao & Monica Olvera de la Cruz.
Por esa razón, el equipo ha diseñado una molécula negativa con capacidad para unirse a la escisión, lo que bloquearía la capacidad del coronavirus de infectar las células humanas. Su estudio fue publicado en ACS Nano.
“Nuestro trabajo indica que bloquear este sitio de escisión puede ser un tratamiento profiláctico viable que disminuya la habilidad del virus para infectar a humanos”, señaló en un comunicado Monica Olvera de la Cruz, coautora de la investigación. “Además, nuestros resultados explican estudios experimentales que mostraban que las mutaciones de la proteína de la espícula afectaban a la transmisibilidad del virus”.
PUEDES VER Rumores y teorías de conspiración sobre la COVID-19 mataron a más de 800 personas, revela estudio
Olvera explica indica que la escisión parece adherirse a una enzima llamada furina, muy abundante en los pulmones, “lo que sugiere que esta región es crucial para la entrada del virus en las células humanas”.
Por su parte, Baofu Qiao, el otro autor del artículo, señala que fue sorpresivo ubicar una región que interactúe con el sitio de unión virus-célula a esa distancia (10 nanómetros). “En condiciones fisiológicas, este tipo de interacciones no suelen ocurrir a más de un nanómetro”
Con estos nuevos hallazgos, Olvera de la Cruz y Qiao planean trabajar con los químicos y farmacólogos de su universidad con el objetivo de elaborar un nuevo fármaco que pueda unirse a la proteína de la espícula y así evitar que las personas se infecten.
Una de las maravillas del mundo antiguo vuelve a la vida: restos del Faro de Alejandría son recuperados desde el fondo del mar
Científicos canadienses crean un método para convertir orina humana en electricidad: las concentradas serían más efectivas
Científicos españoles convierten colillas de cigarrillos en asfalto para pistas y carreteras más duraderas: un país potencia los apoyó
Sorpresa en la comunidad científica: nace la primera cría en libertad de un animal desaparecido de su hábitat tras más de 100 años
Recetas

Tallarines verdes peruanos: receta clásica deliciosa (VIDEO)

Cómo preparar un arroz con pollo tradicional riquísimo (VIDEO)

Sudado de pescado (VIDEO)

Escabeche de pollo receta: fácil y buenazo (VIDEO)
Ofertas

Cineplanet
CINEPLANET: 2 entradas 2D + 2 bebidas grandes + Pop corn gigante. Lunes a Domingo
PRECIO
S/ 47.90
Perulandia
PERULANDIA: FULL DAY + Piscinas + S/. 35 o S/.40 de VALE DE CONSUMO + Perusaurus y más. Según elijas
PRECIO
S/ 59.90
VACILANDIA PARK
VACILANDIA: Full Day + Vale de Consumo. Según elijas
PRECIO
S/ 29.90
La Bistecca
ALMUERZO O CENA BUFFET + Postre + 1 Ice tea de Hierba luisa en sus 4 LOCALES
PRECIO
S/ 85.90


