Falta de normativas frena avance de prueba molecular rápida
Dificultades. Prototipo de esta prueba de bajo costo se halla en fase previa a la final. Para concluir validación requiere de una "hoja de ruta" del Minsa. Aún no se concreta reunión entre equipo científico y ministra Mazzetti.
- Cuando se baila para la Virgen de la Candelaria
- Hernán Garrido Lecca: “Indecopi no gana plata por decomisar libros piratas, pero sí gana plata por poner multas por libros mal compaginados”
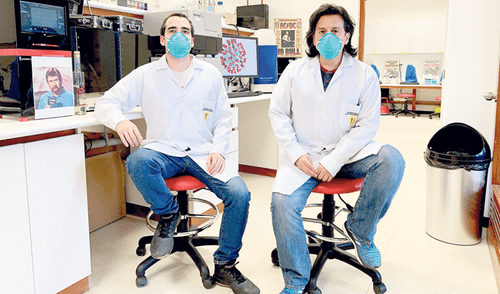
En su último mensaje a la nación, el presidente Martín Vizcarra dijo que los investigadores habían demostrado que “pese a todas las adversidades, sí es posible realizar ciencia en nuestro país”. Aquella vez, incluso, hizo referencia a ocho iniciativas de innovación tecnológica frente al COVID-19. Una de ellas, y que ha generado gran expectativa, ha sido la implementación de pruebas moleculares rápidas. Sin embargo, la falta de normativas del Ministerio de Salud (Minsa) en este contexto de emergencia representan hoy una dificultad para su avance.
“No hay una directiva clara del Minsa para validar las pruebas. Necesitamos esa hoja de ruta que nos diga cómo hacer la segunda fase de validación, necesaria para solicitar su aprobación. Podríamos tomar algún criterio o protocolos internacionales, pero se corre el riesgo de que, después de invertir recursos, nos digan que no era así”, explica Edward Málaga, jefe de la unidad de Neurobiología del Desarrollo de la Universidad Peruana Cayetano Heredia (UPCH), quien lidera esta propuesta de cuatro laboratorios de biología celular y molecular.
TE RECOMENDAMOS
AMENAZAS DE MUERTE EN LA PCM Y DESVÍO MILLONARIO EN LA FRANJA ELECTORAL | ARDE TROYA CON OXENFORD
El equipo de científicos de la UPCH, Ciencias Aplicadas (UPC), y Stanford (EE. UU.) diseñan pruebas moleculares rápidas, portátiles y de bajo costo: los resultados se obtienen en 40 minutos y su precio sería de 50 soles. Además, y a diferencia del método estándar o prueba PCR, bastará con que la persona deposite su saliva en un pequeño tubo, lo cual reduce la exposición del personal de salud. Así ya no se requerirá introducir hisopos en las vías respiratorias.
PUEDES VER: Revisa los candidatos y sus planes de gobierno

Este proyecto ya cuenta con un prototipo, el cual ahora se encuentra en plena validación, etapa previa a la de la producción masiva y la distribución.
PUEDES VER Mazzetti afirma que la próxima semana se tendrá un segundo informe de decesos por la COVID-19
La validación tiene dos fases. Para la primera se ha trabajado con 100 muestras, otorgadas por el Instituto Nacional de Salud (INS) tras el pedido del equipo investigador, las cuales permiten evaluar su eficiencia.
La segunda consiste en la verificación de campo, la cual requiere un mayor número de muestras, que pueden ir de 500 a 2.000. Si el resultado es positivo, debería recibir la aprobación de la Dirección General de Medicamentos, Insumos y Drogas (Digemid) del Minsa.
Pues bien, la primera fase ya está por terminar, pero no hay procedimientos y normativas de emergencia para llevar adelante la segunda. “Para esta etapa se prepara un convenio con EsSalud. Con ellos se podrá invertir en sus fondos, usar su logística, porque serán socios de validación. Pero sin hoja de ruta, nada de ello se podrá realizar. EsSalud no aprueba, sino la Digemid”, precisa Málaga Trillo.
Los puntos pendientes
Este es uno de los temas pendientes de atención del nuevo gabinete, y de la titular de Salud, Pilar Mazzetti, con quien aún no se concreta una reunión, ni se ha pronunciado sobre el tema. Hay que recordar que el exministro Víctor Zamora los recibió dos veces antes de su salida.
En suma, la agenda que aún no avanza en el Estado incluye los nuevos procedimientos para la aprobación y permisos de estos proyectos; la concertación con el Ministerio de Economía y Finanzas, y el de la Producción sobre incentivos tributarios, facilidades legales, logísticas y administrativas para que las empresas inviertan en la elaboración y distribución de nuevos productos biotecnológicos.
A esto se suma, según los científicos, la necesidad de una declaratoria de interés nacional para estos dispositivos desde el Congreso; así como el desarrollo de mecanismos de cooperación con el Minsa para su distribución en todo el país a través del Sistema Nacional de Salud.
En tanto, el equipo trabaja en la búsqueda de más financiamiento para la segunda fase, la cual requerirá, por lo menos, 400 mil dólares; además de las normativas aún ausentes.
Detrás de este proyecto de pruebas rápidas moleculares también están los doctores en Biología Cristina Guerra-Giraldez (UPCH), Vanessa Adaui y Pohl Milón (UPC), y Piere Rodríguez (Stanford, EE. UU.).
La exministra Patricia García, quien lidera el grupo de trabajo sobre innovación y tecnologías convocado por el Minsa, ha advertido de la falta de financiamiento y de políticas para estas propuestas. “Hay que romper los cuellos de botella regulatorios que ni siquiera ahora, en la emergencia, permiten la producción y desarrollo de tecnología nacional”, sostiene.
Según señala, si bien se ha dialogado con la Digemid y el INS, los caminos aún son difíciles. “Es una necesidad la inversión en ciencia y biotecnología; y la creación de puentes regulatorios para avanzar en proyectos contra el COVID-19”, apunta.
Claves
El INS trabaja en una prueba molecular rápida. El 22 de julio, la ministra Mazzetti dijo que en 15 días estaría lista. Sin embargo, aún no hay novedades de la misma.
Este diario se comunicó con el Minsa y el INS para conocer las gestiones de Málaga, pero no hubo respuesta.
Newsletter COVID-19 en Perú de La República
Suscríbete aquí al boletín de La República y recibe a diario en tu correo electrónico toda la información sobre el estado de emergencia y la pandemia de la COVID-19.
Inquilina de La Molina se niega a dejar casa y exige US$15.000 a la dueña para retirarse: acumula deuda millonaria desde hace años
Padre denuncia agresión contra su hija e irregularidades en APAFA dentro de colegio Santa Rosa en Trujillo: "No nos dan justicia"
Falso ingeniero estafó con más de S/440,000 y vendió la casa de su víctima en Tarapoto: registra orden de captura
Recetas

Tallarines verdes peruanos: receta clásica deliciosa (VIDEO)

Cómo preparar un arroz con pollo tradicional riquísimo (VIDEO)

Sudado de pescado (VIDEO)

Escabeche de pollo receta: fácil y buenazo (VIDEO)
Ofertas

Perulandia
PERULANDIA: FULL DAY + Piscinas + S/. 35 o S/.40 de VALE DE CONSUMO + Perusaurus y más. Según elijas
PRECIO
S/ 59.90
VACILANDIA PARK
VACILANDIA: Full Day + Vale de Consumo. Según elijas (ARMONIA 10 este domingo 8 FEBRERO)
PRECIO
S/ 29.90
PARQUE ACUATICO PARAISO DEL SUR
PARAISO DEL SUR: Entrada general full day para Niño o Adulto LUNES A DOMINGO
PRECIO
S/ 43.90
Cineplanet
CINEPLANET: 2 entradas 2D + 2 bebidas grandes + Pop corn gigante. Lunes a Domingo
PRECIO
S/ 47.90


