Moderna solicita autorización para aplicar tercera dosis de su vacuna contra la COVID-19 en Europa
La compañía explicó que la segunda etapa del estudio clínico fue modificada para introducir la tercera dosis, que debería ser inoculada tras seis meses de la segunda.
- China intensifica tensiones con un país de América Latina y advierte que pagará un precio muy alto por anular contrato comercial
- EE. UU. sancionará con arancel adicional del 25% a países que mantengan relaciones comerciales con Irán
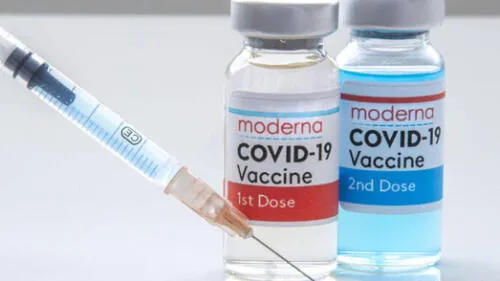
La farmacéutica Moderna anunció este viernes que entregó los primeros resultados de sus ensayos clínicos a las autoridades europeas para la evaluación de una tercera dosis de refuerzo contra la COVID-19 con el objetivo de obtener su autorización.
“Estamos satisfechos de haber solicitado una autorización condicional de comercialización a la Agencia Europea de Medicamentos para nuestra (vacuna) candidata de refuerzo al nivel de dosis de 50 microgramos”, aseguró en un comunicado la farmacéutica estadounidense, que hace dos días hizo lo propio ante las autoridades de Estados Unidos.
TE RECOMENDAMOS
PAJERÍGATE: VISITAS NOCTURNAS A PALACIO Y CONTRATOS MILLONARIOS |LA VERDAD A FONDO CON PEDRO SALINAS
El consejero delegado de Moderna, Stéphane Bancel, apuntó que los estudios y análisis adicionales “muestran que una dosis de refuerzo de 50 microgramos” de su vacuna contra el coronavirus “provoca fuertes respuestas de anticuerpos contra la variante Delta”.
“Seguimos comprometidos a adelantarnos al virus y a seguir la evolución epidemiológica del SARS-CoV-2”, agregó.
La compañía explicó que se modificó la segunda fase del estudio clínico para incluir la tercera dosis administrada aproximadamente seis meses después de la segunda.
El pasado martes, Moderna presentó los datos ante la Administración de Alimentos y Medicamentos de EE. UU. (FDA, por sus siglas en inglés) poco más de dos semanas después de Pfizer, que entonces dijo que la dosis de refuerzo había generado anticuerpos neutralizantes significativamente más altos contra el virus original de la COVID-19, además de las variantes Beta y Delta.
En agosto, la FDA empezó a recomendar el uso de una tercera dosis para las personas con un sistema inmune debilitado, como pacientes de trasplante de órganos, personas con VIH o algunos enfermos de cáncer, que no registraron una respuesta inmune adecuada a las dos primeras vacunas.
Recientemente, las autoridades estadounidenses también anunciaron planes de empezar a ofrecer la dosis de refuerzo a la población general que haya recibido las vacunas mRNA (Moderna y Pfizer), con fecha de inicio el 20 de septiembre para aquellos que se hayan puesto las dos dosis iniciales hace más de ocho meses.
Esto, sin embargo, aún tiene que ser aprobado por la FDA y por los Centros de Control y Prevención de Enfermedades (CDC, por sus siglas en inglés) del país.
China saca de la jugada a Estados Unidos y se convierte en el mayor productor de cobre de este país de América Latina
"Derribemos a Francisco": Epstein y el exjefe de campaña de Trump hablaron de derrocar al papa, según correos
El país de América Latina que rompe record histórico y se consolida como líder mundial en producción de plata
Recetas

Tallarines verdes peruanos: receta clásica deliciosa (VIDEO)

Cómo preparar un arroz con pollo tradicional riquísimo (VIDEO)

Sudado de pescado (VIDEO)

Escabeche de pollo receta: fácil y buenazo (VIDEO)
Ofertas

Perulandia
PERULANDIA: FULL DAY + Piscinas + S/. 35 o S/.40 de VALE DE CONSUMO + Perusaurus y más. Según elijas
PRECIO
S/ 59.90
VACILANDIA PARK
VACILANDIA: Full Day + Vale de Consumo. Según elijas (ARMONIA 10 este domingo 8 FEBRERO)
PRECIO
S/ 29.90
PARQUE ACUATICO PARAISO DEL SUR
PARAISO DEL SUR: Entrada general full day para Niño o Adulto LUNES A DOMINGO
PRECIO
S/ 43.90
Cineplanet
CINEPLANET: 2 entradas 2D + 2 bebidas grandes + Pop corn gigante. Lunes a Domingo
PRECIO
S/ 47.90


