Posible vacuna contra el coronavirus pasa a segunda fase tras aprobación de EE. UU.
La Administración de Drogas y Alimentos fue quien completó su revisión de solicitud. Se espera que la nueva fase comience muy pronto.
- Irán responde al ataque con misiles a Israel y bases militares de EE.UU. en Medio Oriente: "Ahora estamos más preparados que nunca"
- EE.UU. e Israel atacan Irán HOY, EN VIVO: cifra de muertos, imágenes y últimas noticias sobre la ofensiva en Medio Oriente
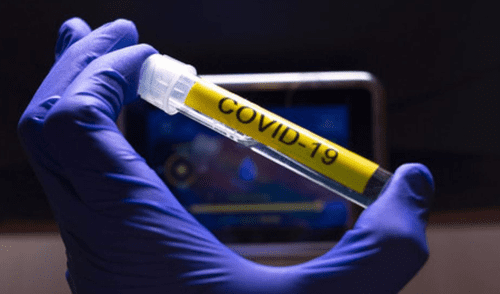
Una vacuna para el coronavirus de la Compañía Moderna fue aprobada por la Administración de Drogas y Alimentos de los Estados Unidos (FDA, por su siglas en inglés) para que proceda a la segunda fase de su estudio.
La compañía fue quien dio a conocer la noticia a través de un comunicado.
TE RECOMENDAMOS
REIKI: QUÉ ES, CÓMO FUNCIONA Y SUS BENEFICIOS EN LA SANACIÓN ENERGÉTICA |ASTROMOOD CON JHAN SANDOVAL
“La Administración de Drogas y Alimentos de los EE. UU. (FDA) completó su revisión de la solicitud de Investigación de Nuevos Medicamentos (IND) de la compañía para su nuevo candidato a la vacuna contra el coronavirus (SARS-CoV-2 o COVID-19) (ARNm-1273), que le permite pasar a la Fase 2 de estudio. Se espera que comience en breve. El protocolo de finalización para el estudio de Fase 3 del ARNm-1273, se espera que comience a principios del verano de 2020”, indica el comunicado de Moderna.
La vacuna mRNA-1273 fue la primera norteamericana en comenzar las pruebas clínicas en Estados Unidos. El ensayo ayudará a los investigadores a evaluar si la vacuna es segura, quién produce la respuesta inmune más fuerte que podría defenderse de la cepa letal y cuál debería ser la dosis eficiente para tratar el mal.
Esta vacuna -como todas las que están en proceso- utiliza una tecnología basada en genes conocida como ARN mensajero. El ARN mensajero, o ARNm, lleva instrucciones del ADN a las células del cuerpo para producir ciertas proteínas. Una vacuna de ARNm nunca ha sido aprobada para prevenir enfermedades infecciosas.
En Londres también existe un centenar de proyectos de vacunas contra la enfermedad COVID-19, entre ellos una decena en fase de ensayos clínicos, según datos difundidos por la London School of Hygiene & Tropical Medicine.
Esta prestigiosa escuela de medicina británica enumera 119 proyectos diferentes de vacunas contra la enfermedad causada por el coronavirus SARS-CoV-2, de los cuales 110 se encuentran en una fase de desarrollo “preclínica”.
La televisión estatal de Irán confirma la muerte del líder supremo Alí Jamenei tras 36 años en el poder
Donald Trump confirma la muerte de Alí Jamenei, ayatolá y líder supremo de Irán tras ataque de Israel
EN VIVO, EE. UU. e Israel atacan Irán: Donald Trump confirma la muerte de Alí Jamenei, ayatolá y líder supremo
Medios iraníes reportan la muerte de la hija, el yerno y la nieta de Jamenei en ataques de EE. UU. e Israel
Recetas

Tallarines verdes peruanos: receta clásica deliciosa (VIDEO)

Cómo preparar un arroz con pollo tradicional riquísimo (VIDEO)

Sudado de pescado (VIDEO)

Escabeche de pollo receta: fácil y buenazo (VIDEO)
Ofertas

Cineplanet
CINEPLANET: 2 entradas 2D + 2 bebidas grandes + Pop corn gigante. Lunes a Domingo
PRECIO
S/ 47.90
Perulandia
PERULANDIA: FULL DAY + Piscinas + S/. 35 o S/.40 de VALE DE CONSUMO + Perusaurus y más. Según elijas
PRECIO
S/ 59.90
VACILANDIA PARK
VACILANDIA: Full Day + Vale de Consumo. Según elijas
PRECIO
S/ 29.90
La Bistecca
ALMUERZO O CENA BUFFET + Postre + 1 Ice tea de Hierba luisa en sus 4 LOCALES
PRECIO
S/ 85.90


