FDA retira antidepresivo Cymbalta del mercado por sustancia química que "puede aumentar el riesgo de cáncer"
La FDA retira más de 7.000 frascos de Cymbalta por posible impureza cancerígena; consulta los lotes afectados y las recomendaciones para pacientes.
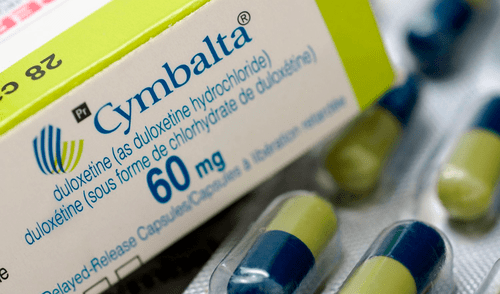
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, por sus siglas en inglés) ha emitido un retiro de mercado para el antidepresivo Cymbalta, utilizado para tratar la ansiedad y la depresión. Esta medida, anunciada el 10 de octubre, afecta a más de 7,000 frascos de este medicamento producidos por Towa Pharmaceutical Europe. La razón de esta decisión radica en la presencia de una impureza química conocida como N-nitroso-duloxetina, una forma de nitrosamina que podría elevar el riesgo de cáncer si se consume en cantidades elevadas o durante periodos prolongados.
La FDA ha clasificado el retiro como de Clase II, indicando que el producto podría causar efectos temporales o médicamente reversibles en la salud. El lote afectado es el número 220128, con fecha de caducidad en diciembre de 2024. Los pacientes que posean este medicamento están siendo aconsejados a consultar a sus médicos para discutir posibles alternativas y evaluar los riesgos.
La FDA anunció que el lote número 220128 es el afectando, catalogándolo como un retiro de Clase II. Foto: Recreate Life Counseling
¿Por qué la FDA retiró Cymbalta?
La decisión de la FDA de retirar Cymbalta se debe a la detección de N-nitroso-duloxetina, una nitrosamina que puede representar un riesgo para la salud. Estos compuestos químicos, presentes en algunos medicamentos, alimentos y agua potable, son potencialmente cancerígenos cuando se ingieren en niveles elevados o por tiempos prolongados. Si bien se consideran seguros en pequeñas cantidades, la preocupación crece cuando la exposición es continua y supera los límites de ingesta diaria establecidos.
La FDA recomienda a los pacientes en posesión de Cymbalta del lote afectado que eviten su consumo hasta recibir asesoría médica. “Los pacientes deben hablar con sus profesionales de la salud sobre sus preocupaciones y explorar otras opciones de tratamiento”, declaró la agencia. Este retiro se suma a otros realizados por la FDA en un esfuerzo por reducir la exposición a nitrosaminas en productos de uso diario y medicamentos.
La FDA detectó N-nitroso-duloxetina, nitrosamina que representa un riesgo para la salud. Foto: Ilustrativa
¿Qué medicamentos han sido retirados por cancerígenos en EE. UU.?
Desde 2018, la FDA ha retirado múltiples medicamentos del mercado debido a la presencia de nitrosaminas. Uno de los primeros fue el valsartán, un medicamento para la presión arterial, seguido de otros productos como losartán. Más de 12 millones de frascos de estos medicamentos fueron retirados después de detectar niveles elevados de nitrosaminas en su composición.
Además de medicamentos para la presión arterial, otros productos han sido afectados, incluyendo Zantac, utilizado para la acidez; metformina, un tratamiento común para la diabetes; y Chantix, una terapia para dejar de fumar. Todos estos productos fueron retirados por la misma razón: la presencia de nitrosaminas. Estas medidas buscan reducir riesgos potenciales para la salud de los consumidores, especialmente en tratamientos de uso prolongado.
¿Qué son las nitrosaminas?
Las nitrosaminas son compuestos químicos que pueden formarse durante el proceso de fabricación o el almacenamiento de ciertos productos. Presentes también en alimentos como carnes procesadas y algunos productos lácteos, estas sustancias son seguras en niveles bajos, pero estudios han vinculado su ingesta continua en altas dosis con un mayor riesgo de cáncer.
A nivel mundial, la presencia de nitrosaminas en medicamentos ha generado mayor escrutinio, y la FDA trabaja activamente en el monitoreo y regulación de estos compuestos en productos farmacéuticos. La agencia insta a los consumidores a mantenerse informados y seguir las recomendaciones médicas y gubernamentales, especialmente si toman medicamentos de lotes afectados por estas impurezas.
¿Qué pasa con César Millán? El 'encantador de perros' es tendencia en EEUU tras rumores de un supuesto arresto
Recetas

Tallarines verdes peruanos: receta clásica deliciosa (VIDEO)

Cómo preparar un arroz con pollo tradicional riquísimo (VIDEO)

Sudado de pescado (VIDEO)

Escabeche de pollo receta: fácil y buenazo (VIDEO)
Ofertas

Cineplanet
CINEPLANET: 2 entradas 2D + 2 bebidas grandes + Pop corn gigante. Lunes a Domingo
PRECIO
S/ 47.90
Perulandia
PERULANDIA: FULL DAY + Piscinas + S/. 35 o S/.40 de VALE DE CONSUMO + Perusaurus y más. Según elijas
PRECIO
S/ 59.90
VACILANDIA PARK
VACILANDIA: Full Day + Vale de Consumo. Según elijas
PRECIO
S/ 29.90
La Bistecca
ALMUERZO O CENA BUFFET + Postre + 1 Ice tea de Hierba luisa en sus 4 LOCALES
PRECIO
S/ 85.90

