
No, Pfizer no cambió de versión sobre estudio para reducir la propagación del virus SARS-CoV-2
Contrario a lo que afirman usuarios, la empresa expuso al inicio de la comercialización de la vacuna contra la COVID-19 que aún no se determinaba si la solución prevenía el contagio. Además, las farmacéuticas solo debían acreditar que las vacunas eran seguras y que evitaban el desarrollo de una enfermedad grave.
De acuerdo a usuarios en redes sociales, la “compañía farmacéutica Pfizer admite que lanzó la vacuna (contra la COVID-19) sin que esta haya sido probada para contrarrestar la transmisión del coronavirus, en contra de lo que admitieron en su momento”.
Por ello, las publicaciones que han viralizado la información señalan que esta supuesta revelación “debería inquietar a todas las personas que se inocularon la sustancia que Pfizer colocó en millones de viales distribuidos por toda Europa y otras partes del mundo”.
Como prueba, usuarios adjuntaron en los posteos una declaración de representantes de la empresa farmacéutica donde mencionaron que su vacuna no fue probada para detener la transmisión. No obstante, la información es engañosa, ya que la compañía no afirmó haber realizado esa prueba que garantizara la cero transmisión y tampoco era un requisito para la aprobación de emergencia.

Publicación viral en redes sociales. Foto: captura LR/Facebook.
¿Cuáles fueron los requisitos para la aprobación de las vacunas contra la COVID-19?
De acuerdo a la Organización Mundial de la Salud (OMS), existen dos formas para autorizar el uso de una vacuna: mediante una autoridad nacional regulatoria y a través de la lista de uso de emergencia de la OMS.
La lista de uso de emergencia, según la organización, “es un procedimiento para evaluar e incluir en la lista de vacunas, terapias y diagnósticos in vitro productos sin licencia con el objetivo de acelerar la disponibilidad de estos para las personas afectadas por una emergencia de salud pública”.
¿Esto significa que no se realizan pruebas? Falso. De acuerdo al protocolo de la lista de uso de emergencia, se realiza una “rigurosa evaluación de los datos clínicos proporcionados por los fabricantes de vacunas” y se señala que “si existen dudas sobre su seguridad o eficacia, la vacuna no recibirá la recomendación”.
El procedimiento de aprobación incluyó: la evaluación de los datos de los ensayos clínicos de fase II y fase III, datos sobre seguridad, eficacia y calidad y gestión de riesgos. Además, la información fue revisada por expertos independientes y se hizo un compromiso para que los fabricantes continuaran con los estudios para la “plena aprobación”.
El investigador Percy Mayta explicó a este medio en qué consiste cada una de las fases de estudio que garantizan la eficiencia y seguridad para la aprobación de vacunas. Una vacuna experimental, expuso Mayta, debe probarse inicialmente en animales: esta fase es conocida como preclínica. Luego de comprobar que es eficaz y segura en esta etapa, pasa a la prueba en humanos.
Esta aplicación en personas es conocida como fase clínica y tiene tres partes: prueba en pequeños grupos para garantizar la seguridad (fase I), prueba en grupos de cientos de personas para comprobar eficacia y seguridad (fase II) y prueba masiva en miles de personas para terminar de comprobar los puntos antes mencionados (fase III).
Es decir, la llegada a la fase III solo se da si es que ha demostrado ser segura y eficaz en las fases II, I y etapa preclínica. Por su parte, Erika Castillo, PhD en Ciencias Médicas, explicó a Verificador en una nota anterior que aunque es cierto que las vacunas aprobadas bajo la modalidad de emergencia aún se encontraban en fase III, esto no compromete su calidad.
Castillo comentó que las soluciones cumplieron en la fase III con cuatro características importantes antes de pasar a la lista de vacunas autorizadas: se encontraban en fase III, reportaron datos de estudios validados sobre su eficacia, mostraron capacidad de desarrollar respuesta inmune y que los riesgos no sean severos.
Es decir, en ninguno de los casos era un requisito un estudio que probara la reducción de contagio del coronavirus a consecuencia de la aplicación de las vacunas.
Por otro lado, en Perú, para el caso específico de Pfizer mencionado en el viral, la Dirección General de Medicamentos, Insumos y Drogas (DIGEMID) solicitó una serie de requerimientos a cumplir por parte de la farmacéutica para su aprobación.
Entre ellos, los informes de los estudios clínicos de las fases I y II. Asimismo, se realizó el compromiso de entrega del informe final de los estudios de todas estas (I, II y III) para diciembre del 2023. En este caso tampoco se pidió una prueba que garantizara la reducción de la transmisión.
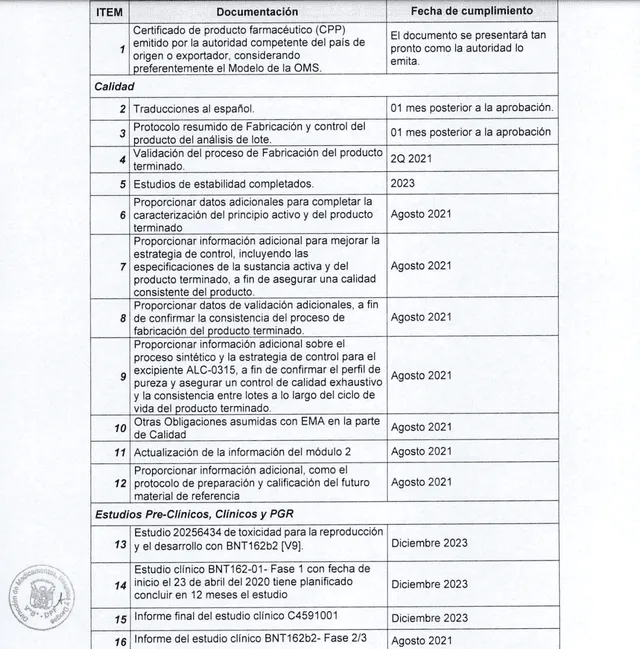
Requisitos de DIGEMID para aprobar la aplicación de la solución de Pfizer en Perú. Foto: captura LR/DIGEMID.
Asimismo, el Gobierno del Perú, en el momento de la aprobación de la solución, debido aún se continuaban realizando estudios, recalcó que se debía seguir cumpliendo con medidas preventivas como el uso de mascarilla, distanciamiento, lavado de manos, entre otras.
¿Qué fue lo que dijo Pfizer que originó la desinformación en redes sociales?
Usuarios han difundido un extracto de lo que fue el Comité Especial sobre la pandemia de la COVID-19, llevado a cabo el 10 de octubre de 2022, para sustentar que la farmacéutica “admitió” que no probó la solución para reducción del contagio. En el video, el eurodiputado conservador Robert Roos sostiene un diálogo con un representante de Pfizer de apellido Small.
Roos preguntó en el minuto 15 segundo 20: “¿Se probó la vacuna covid Pfizer para detener la transmisión del virus antes de que entrara en el mercado?”. Small respondió: “No, tuvimos que movernos a la velocidad de la ciencia”.
Como hemos mencionado líneas arriba, no era un requisito probar que la vacuna no transmitía el virus. Sin embargo, usuarios en redes sociales afirmaron que desde Pfizer inicialmente afirmaron que su solución sí evitaba la transmisión. Esto es falso.
Antes de que la vacuna de Pfizer empezara a comercializarse en Perú y en el mundo, en noviembre de 2020 investigadores de la farmacéutica informaron a Reuters que aún estaban investigando si la vacuna evitaba por completo la infección o si solo reducía la gravedad de la enfermedad.
“Queremos ser capaces de protegernos completamente de la infección… pero la sutileza allí, que es importante, es que si estás infectado aún puedes transmitir el virus”, explicó Lawrence Young, de la Universidad de Warwick de Gran Bretaña.
Es decir, antes de que las personas fueran masivamente inoculadas, la compañía informó que no conocían si prevenía la propagación. Sin embargo, indicaron que tenía más de 90% de efectividad para prevenir la enfermedad grave.
Un mes después, la Agencia Europea de Medicina aprobó el uso extraordinario de esta vacuna. Al final de diciembre de 2020, esta entidad informó que aún no se conocía el impacto de la vacuna de Pfizer en relación con la propagación del virus SARS-CoV-2: “Todavía se desconoce qué tanto pueden portar y propagar el virus las personas vacunadas”.
Fue en febrero de 2021, que se comunicó que estudios realizados luego de la aplicación de la solución de Pfizer determinaron que la inoculación sí reduce la transmisión del virus. De acuerdo a Michal Lineal, profesor de biología molecular y bioinformática en la Universidad Hebrea de Jerusalén, aunque se necesitaba más investigación para obtener una conclusión, los estudios sugirieron que la vacuna puede detener la propagación y no solo evitar una enfermedad grave.
Actualmente, en agosto de 2022, la revista Nature publicó un artículo llamado “Las vacunas COVID reducen el riesgo de propagar Omicron, al igual que la infección previa”. En este texto se expone que las personas que se infectan con la variante Omicron “tienen menos probabilidades de transmitir el virus a otras personas si han sido vacunadas o han tenido una infección previa por SARS-CoV-2″.
Sin embargo, el estudio señaló que la reducción empezó a disminuir con el paso del tiempo desde la inoculación o desde la infección.
Por tanto, contrario a lo insinuado en la publicación viral, la farmacéutica Pfizer no acaba de admitir que su vacuna contra la COVID-19 no reducía la transmisión del virus, ya que desde antes de que empezó su comercialización se especificó que aún estaba en investigación ese punto.
Conclusión
Es engañoso decir que Pfizer “admitió” que no probó que su vacuna contra la COVID-19 reducía la propagación del virus. La farmacéutica informó que aún desconocían si evitaba la transmisión del coronavirus antes de la comercialización de la solución. Además, estudios realizados luego de que empezó la inoculación masiva han determinado que sí existe una reducción.
Por otro lado, para la aprobación por emergencia de las vacunas solo era necesario que se probara que eran efectivas y seguras para evitar la enfermedad grave de la COVID-19.
Podcast Verificador LR
Escucha el podcast de Verificador de La República, nuestra selección dominical de artículos de fact-checking que desmienten los contenidos falsos que circulan en las redes sociales.
*Si deseas saber si una publicación en las redes sociales es cierta o falsa, puedes pedir a La República que compruebe la información. Envía tu solicitud al apartado Contacto o escríbenos al WhatsApp (+51 997 883 271).
