
Es engañoso afirmar que la FDA desautorizó el uso de vacunas contra la COVID-19 de Pfizer y Moderna
La Administración de Alimentos y Medicamentos retiró la autorización de las vacunas monovalentes para optimizar la inoculación con la opción bivalente.
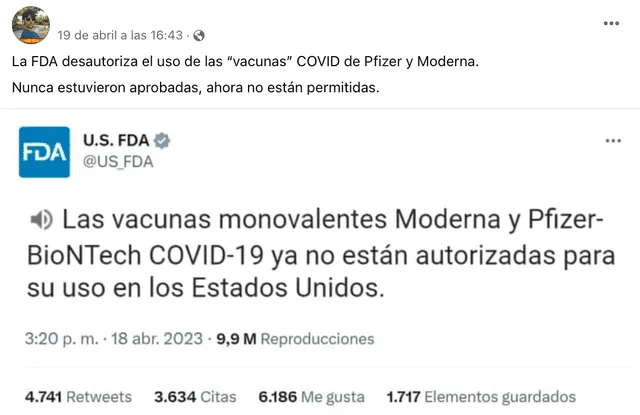
“La FDA (Administración de Alimentos y Medicamentos) desautoriza el uso de las ‘vacunas’ COVID de Pfizer y Moderna. Nunca estuvieron aprobadas, ahora no están permitidas”, se lee en una publicación difundida por usuarios de las redes sociales Twitter y Facebook que adjunta un tuit emitido por la agencia estadounidense el 18 de abril de 2023.
Debido al anuncio, las personas que han difundido la noticia han lanzado comentarios para desacreditar las vacunas contra la COVID-19. Sin embargo, aunque es cierto que las vacunas monovalentes ya no están autorizadas, el tuit fue sacado de contexto, ya que la decisión fue tomada con el objetivo de potenciar la inoculación con soluciones bivalentes.
La decisión de la FDA busca simplificar la vacunación con dosis bivalentes
El 18 de abril de 2023, la Administración de Alimentos y Medicamentos (FDA), agencia del Gobierno de los Estados Unidos responsable de la regulación de alimentos, medicamentos, cosméticos, aparatos médicos, productos biológicos y derivados sanguíneos, publicó un hilo de Twitter anunciando la modificación de la Autorización de Uso de Emergencia (EUA) de las vacunas bivalentes de ARNm contra la COVID-19 de Pfizer-BioNTech y Moderna “para simplificar el programa de vacunación para la mayoría de las personas”.
Cabe destacar que la vacuna bivalente contiene dos componentes de protección, el primero del virus original SARS-CoV-2 y el segundo de los linajes de Omicron que predominan en el mundo. Esto permite que el organismo presente una mejor respuesta inmune frente a una infección, a diferencia de la vacuna monovalente, que protege solo contra el virus original.
De acuerdo a la agencia de gobierno estadounidense, la modificación de los EUA permite “autorizar el uso de las vacunas bivalentes actuales (cepas originales y omicron BA.4/BA.5) para todas las dosis administradas a personas de 6 meses de edad y mayores". Este cambio tendría como resultado, y aquí surgió la desinformación, la desautorización de las vacunas monovalentes de Moderna y Pfizer-BioNTech. Esta información fue dada en el tercer tuit del hilo publicado por la FDA.
El comunicado también indica que las personas vacunadas previamente con una vacuna monovalente contra la COVID-19, que aún no han recibido una dosis bivalente, pueden recibir una dosis única. Las personas que solo han recibido una dosis bivalente no son elegibles para otra dosis hasta nuevo aviso. Sin embargo, los mayores de 65 años que han recibido una dosis bivalente pueden recibir una adicional, al igual que personas con ciertos tipos de inmunodepresión y condiciones médicas especiales.
La modificación y recomendaciones que desplazan a la vacuna monovalente tienen como objetivo, según la FDA, que “las personas que no han sido inoculadas contra la COVID-19 hasta el momento puedan recibir solo una dosis de la vacuna bivalente, en lugar de dosis múltiples de la vacuna monovalente ARN”. De esa manera, la inoculación sería más sencilla.
Seguridad de las vacunas bivalentes
De acuerdo a la FDA, la seguridad y eficacia de la vacuna bivalente contra la COVID-19 de Moderna “se basa en los análisis previos de la FDA de los datos de ensayos clínicos de la vacuna monovalente en personas de 6 meses de edad y mayores y una vacuna Moderna COVID-19 bivalente en investigación en personas mayores de 18 años”. Asimismo, la agencia recalca que las vacunas monovalentes y bivalentes “se fabrican utilizando en mismo proceso”, por lo que, al ser seguras las monovalentes, las bivalentes también lo son.
De igual forma, la FDA expuso que “la seguridad y eficacia de la vacuna bivalente contra la COVID-19 de Pfizer-BioNTech se basa en los análisis previos de la FDA de datos de ensayos clínicos de la vacuna monovalente de Pfizer en personas de 6 meses en adelante, una vacuna bivalente en investigación y datos de respuesta inmune”.
Es decir, la aprobación y autorización de las vacunas bivalentes se dio gracias a los estudios realizados con anterioridad para aprobar y autorizar el uso de las dosis monovalentes.
Las vacunas monovalentes sí se aprobaron
De acuerdo al registro de comunicados de la FDA, el 11 de diciembre del año 2020, la agencia estadounidense emitió una Autorización de Uso de Emergencia (EUA) “de la vacuna Pfizer-BioNTech para la prevención de COVID-19 en personas de 16 años de edad y mayores”.
Días después, el 18 de diciembre de 2020, “la Administración de Alimentos y Medicamentos (FDA) emitió una Autorización de Uso de Emergencia (EUA) de la vacuna para prevenir contra la COVID-19 para individuos mayores de 18 años y mayores”.
El 31 de agosto de 2022 el FDA autorizó las vacunas bivalentes para su uso como dosis de refuerzo después de la vacunación primario o de refuerzo. Es decir, su aplicación ya había sido aprobada. El cambio actual ha sido darles prioridad a las bivalentes, que ofrecen mayor protección, a fin de facilitar la inoculación.
Conclusión
La información compartida en redes sociales sobre la desautorización de las vacunas contra la COVID-19 es engañosa. La FDA sí retiró la autorización para las monovalentes de Pfizer y Moderna, pero lo hizo con el objetivo de que solo se usen las soluciones bivalentes que ofrecen mayor protección y al ser de una sola aplicación, vuelven la inoculación más sencilla.
Si deseas saber si una publicación en las redes sociales es cierta o falsa, puedes pedir a La República que compruebe la información. Envía tu solicitud al apartado Contacto o escríbenos al WhatsApp (+51 997 883 271).
