Post sobre evaluación de Pfizer acerca de los riesgos de miocarditis en niños es engañoso
Cibernautas sugieren que la farmacéutica no realizó estudios en los ensayos clínicos sobre esta enfermedad por falta de tiempo, pero esto no es cierto.
“Pfizer admite que no tuvo tiempo de evaluar los riesgos de miocarditis en niños”, alertan publicaciones en Facebook y Twitter. Difunden un extracto del canal de televisión español 7NN en el que la reportera Lucía Abajo expone que la farmacéutica aceptó que “los ensayos clínicos fueron cortos para determinar riesgo de miocarditis en niños e informó mal la cantidad de muertes”.
Señala que en la página 11 de un informe de la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) se indica que “Pfizer ha asegurado que los ensayos clínicos que se hicieron en las vacunas fue durante un periodo de tiempo muy corto”.
Afirma también que las vacunas contienen trometamina, que es “un fármaco que se usa para tratar acidosis metabólica, que a menudo ocurre después de una cirugía por un paro cardiaco”. Ella finaliza diciendo que estos datos “asustan”.
Al momento, estos post presentan más de 26.000 reproducciones y 1.200 ‘me gusta’ en las redes sociales. Sin embargo, la información ofrecida es engañosa.
En el informe no se especifica que Pfizer no realizó estudios de miocarditis en niños por falta de tiempo
Primeramente, como se definió en otra verificación, la miocarditis es una enfermedad poco común que se caracteriza “por la inflamación del músculo cardíaco, llamado miocardio, y otros cambios en las células del músculo cardíaco que pueden ser agudos o crónicos”, según el Instituto Nacional del Corazón, los Pulmones y la Sangre de los Estados Unidos.
El documento al que apuntan estas publicaciones es un reporte de la FDA, del 26 de octubre de 2021. En la página 11 se indica que la inmunización con la vacuna de Pfizer en niños de 5 a menores de 12 años mostró “un perfil favorable de seguridad y tolerabilidad, respuestas inmunitarias sólidas contra todas las variantes de preocupación”.
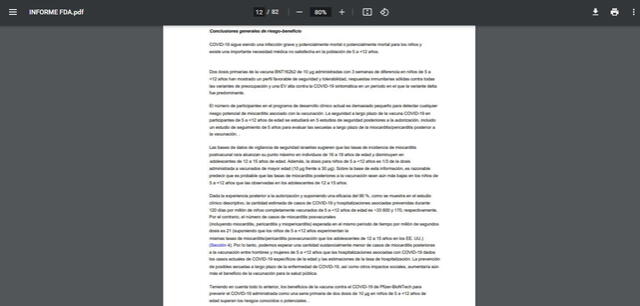
Seguidamente, se asegura que “el número de participantes en el programa de desarrollo clínico actual es demasiado pequeño para detectar cualquier riesgo potencial de miocarditis asociado con la vacunación”.
No obstante, se precisa que la seguridad a largo plazo de esta inyección en este grupo etario se evaluará en cinco estudios luego de la autorización de la inyección, incluida una evaluación de seguimiento de cinco años para estudiar “las secuelas a largo plazo de la miocarditis / pericarditis posterior a la vacunación”.
Al respecto, el informe de la FDA cita la información sobre seguridad de estudios israelíes “que sugieren que las tasas de incidencia de miocarditis postvacunal rara alcanzan su punto máximo en individuos de 16 a 19 años de edad y disminuyen en adolescentes de 12 a 15 años de edad”.
Por lo tanto, el texto anticipa la probabilidad de que las tasas de esta afección “sean aún más bajas” en los niños de entre 5 y 12 años que en el grupo de 12 a 15 años. Además, añade que incluso esta población recibe la vacuna pediátrica en 1/3 de la dosis administrada a vacunados de mayor edad.
En otra parte de este informe se enfatiza que “el tamaño de la base de datos de seguridad no es lo suficientemente grande como para detectar cualquier riesgo potencial de miocarditis asociado con la vacunación”. Es decir, se hace una observación respecto de la cantidad de participantes, pero no al tiempo de duración de la investigación. Por ello, en el reporte se reitera que se incluirán estudios posvacunación.
Informe. Foto: captura en web / FDA.
Ángel Hernández Merino, miembro del Comité Asesor de Vacunas de la Asociación Española de Pediatría (APE), dijo para un artículo de Newtral que dicho informe se refiere a un ensayo en el que no se pueden identificar “efectos adversos tan infrecuentes”.
Explicó que un medicamento genera “un efecto secundario grave en uno de cada millón de dosis o personas que lo reciben”. Entonces, detalló: “En un ensayo de fase 3 pueden participar de unos pocos cientos a unos pocos miles de participantes. Es evidente que la probabilidad de que en el grupo de estudio que recibe el medicamento se encuentre esa persona de entre un millón es muy baja, prácticamente cero”.
Sostuvo que estos posibles efectos secundarios son detectados durante la “farmacovigilancia post autorización”, es decir, durante el uso masivo de la vacuna.
Por su parte, en un documento de la Agencia Europea de Medicamentos (EMA. por sus siglas en inglés) se indica que en los ensayos clínicos de cualquier medicamento se incluye un número limitado de participantes, a los que se les hace un seguimiento “durante un periodo relativamente corto en condiciones controladas”.
“Como resultado, ciertos efectos secundarios, particularmente los raros o muy raros, solo surgen durante el uso en la vida real en muchas personas diferentes. Por lo tanto, es esencial controlar de cerca la seguridad y la eficacia de cualquier medicamento después de que se autorice”, señala.
La trometamina se utiliza en diversas condiciones médicas
Por otro lado, como lo señala DrugBank, una base de datos canadiense, la trometamina se usa “para la prevención y corrección de la acidosis metabólica asociada con diversas condiciones clínicas, como la cirugía de derivación cardíaca”. Es decir, no es exclusivamente para pacientes con afecciones al corazón.
Pfizer confirmó a Newtral que esta sustancia es un componente de la vacuna, que es un sustituto del tampón fosfato salino (PBS, por sus siglas en inglés), una solución estabilizadora. Detalló que el cambio fue aprobado por las autoridades sanitarias europeas y estadounidenses.
La EMA también aseguró a dicho medio que “la nueva formulación de la vacuna de Pfizer-BioNTech contiene tampón Tris en lugar del PBS utilizado en la formulación original”. “Esto permite que la vacuna sea más estable y pueda almacenarse durante más tiempo antes de ser administrada. Esta nueva formulación también estará disponible para los mayores de 12 años”, especificó. La trometamina también es conocida como tampón Tris, según el Centro Nacional de Información y Biotecnológica.
Asimismo la FDA afirmó a Newtral que la trometamina también es utilizada en la vacuna de Moderna y otras inyecciones autorizadas, que no son contra COVID-19, como Dengvaxia (vacuna contra el dengue), Jynneos (vacuna contra la viruela y la viruela del mono) y Ervebo (vacuna contra el virus ébola Zaire)”. Incluso añadió que este tampón se emplea en otros medicamentos con indicaciones pediátricas.
Finalmente, en el mencionado informe de la FDA de octubre de 2021 no se asocia ninguna muerte con la vacunación.
Miocarditis y vacunación
El 31 de diciembre de 2021, los Centros de Control y Prevención de Enfermedades (CDC) de Estados Unidos publicaron el informe “Seguridad de la vacuna COVID-19 en niños de 5 a 11 años”. En este reporte se indicó que la miocarditis en este grupo etario “parece rara”.
Se reportaron 15 informe preliminares, de los cuales 11 casos cumplieron con la definición de la enfermedad. De estos últimos, siete se recuperaron y cuatro se estaban recuperando al momento del informe. Señaló que se presentó la muerte de dos mujeres de 5 y 6 años con “antecedentes médicos complicados”, pero que los casos estaban en revisión y que “ninguno de los datos sugirió una asociación causal entre la muerte y la vacunación”.
En un artículo de la revista The Conversation publicado el 17 de enero de 2022, se sostuvo que “la miocarditis después de la vacunación contra la COVID-19 es rara y el riesgo es mucho menor que los riesgos de lesión cardíaca relacionada con la propia COVID-19″.
Especificó que “la incidencia más alta de miocarditis” con vacunas de ARNm, durante la inmunización masiva, ocurrió en hombres menores de 30 años dentro de los tres o cuatro días posteriores a la segunda dosis. “En datos pediátricos, la mediana de edad es de 15,8 años, y la mayoría de los pacientes son hombres (90,6%) y blancos (66,2%) o hispanos (20,9%)”, agregó.
Conclusión
El informe, citado por las publicaciones virales, es real. Se trata de un documento de la FDA publicado en octubre de 2021. En este no se asevera que durante los ensayos clínicos no se estudió el riesgo de miocarditis en niños por falta de tiempo. Se precisó que la base de datos de seguridad no era “suficientemente grande” para asociar miocarditis con la vacunación. Esta enfermedad generalmente se reporta en campañas de vacunación masiva y no en estudios clínicos en los que el número de participantes es limitado.
Además, en ese reporte de la FDA no se asoció la muerte con la inmunización. Y la trometamina es un componente de las vacunas de Pfizer-BioNTech y también ha sido empleado en otras inyecciones, que no son contra COVID-19. Por ello, calificamos estas publicaciones como engañosas.
Podcast Verificador LR
Escucha el podcast de Verificador de La República, nuestra selección dominical de artículos de fact checking desmintiendo la información falsa que circula en las redes sociales.
*Si deseas saber si una publicación en las redes sociales es cierta o falsa, puedes pedir a La República que compruebe la información. Envía tu solicitud al apartado Contacto o escríbenos a nuestro WhatsApp (+51 997 883 271).
