Qué conocemos del remdesivir, el medicamento aprobado para tratamiento del coronavirus
Donald Trump anunció que se permitirá el uso del antiviral en pacientes hospitalizados que sean portadores del coronavirus.
- El país de Sudamérica que pedirá VISA a los ciudadanos de Estados Unidos desde 2025
- Los únicos países de América Latina que serán ricos en 2030 y parte del top 10 del ranking mundial
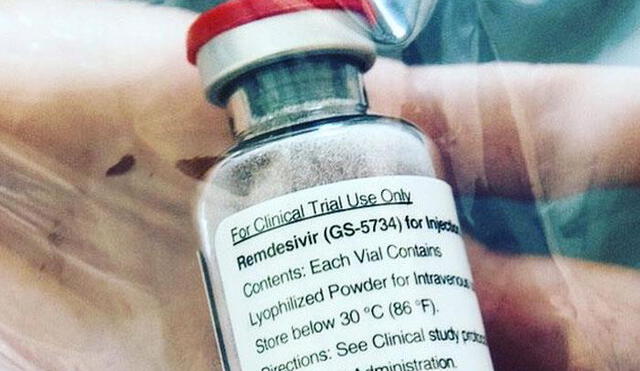
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA) autorizó el uso de emergencia del fármaco experimental Remdesivir en pacientes con COVID-19, anunció el viernes el presidente Donald Trump.
El uso de este antiviral fabricado por el laboratorio estadounidense Gilead Sciences fue aprobado luego de que un importante ensayo clínico mostrara que acorta el tiempo de recuperación en algunos pacientes con el nuevo coronavirus. Fue la primera vez que un medicamento demostró un beneficio contra la enfermedad.

El Remdesivir está siendo probado en China y Estados Unidos. Fuente: EPA / foto referencial.
“Es realmente una situación muy prometedora”, dijo Trump en la Casa Blanca, junto al presidente ejecutivo de Gilead, Daniel O’Day. “Queremos asegurarnos de que nada se interponga en el camino para que estos pacientes reciban el medicamento”. agregó.
La compañía anunció previamente que donaría alrededor de 1,5 millones de dosis. Esto equivale a aproximadamente 140.000 tratamientos, basados en una duración de 10 días.

“Los datos muestran que el remdesivir tiene un efecto claro, significativo y positivo”, dijo el doctor Anthony Fauci. Foto: AFP.
¿Qué es el Remdesivir?
El Remdesivir, que se administra mediante una inyección, es un antiviral de amplio espectro que inhibe el proceso de replicación del virus en el organismo, se incorpora al genoma del virus, provocando un cortocircuito en su proceso de replicación.
Primero se desarrolló para tratar el ébola, una fiebre hemorrágica viral, pero no aumentó las tasas de supervivencia como otros medicamentos.
El medicamento ya estaba disponible para algunos pacientes que se inscribieron en ensayos clínicos, o que lo recibieron al margen de esas pruebas en la llamada modalidad de “uso compasivo”. Es decir, ha sido probada en voluntarios sanos y en infectados, dando resultados positivos en laboratorios norteamericanos.
La aprobación permite que se distribuya mucho más ampliamente y se use tanto en adultos como en niños hospitalizados que estén graves.
La Administración de Alimentos y Medicamentos (FDA), que dio luz verde a este uso de emergencia, define el estado de gravedad con bajos niveles de oxígeno en la sangre, lo que hace necesario recibir terapia o estar conectado a un respirador.
PUEDES VER Estados Unidos: Donald Trump anunció que no prolongará las medidas de distanciamiento social
El Instituto Nacional de Alergias y Enfermedades Infecciosas de Estados Unidos (NIAID) reveló el miércoles los resultados alentadores de un ensayo clínico que involucró a más de 1.000 personas.
Descubrió que los pacientes hospitalizados con COVID-19 con dificultad respiratoria mejoraron más rápido que los que recibieron un placebo. Específicamente, los pacientes que tomaron el medicamento tuvieron un tiempo de recuperación 31 % más rápido.
“Aunque los resultados fueron claramente positivos desde un punto de vista estadísticamente significativo, fueron modestos”, dijo, sin embargo, el jueves, Anthony Fauci, un científico que dirige el NIAID y uno de los principales asesores de Trump en esta pandemia.

Remdesivir
Pero si bien no se considera una cura milagrosa, el ensayo de remdesivir podría allanar el camino para mejores tratamientos, según Fauci.
Con información de AFP
Los artículos firmados por La República son redactados por nuestro equipo de periodistas. Estas publicaciones son revisadas por nuestros editores para asegurar que cada contenido cumpla con nuestra línea editorial y sea relevante para nuestras audiencias.
